共聚焦显微镜通过图像相关谱揭示细胞表面受体聚集
Summary
与细胞表面上的靶受体结合的抗体可以赋予构象和聚类改变。这些动态变化对表征靶细胞内药物的发展有影响。该协议利用共焦显微和图像相关光谱学通过 ImageJ/斐济, 以量化的程度, 受体聚类在细胞表面。
Abstract
共焦显微术提供了一个可访问的方法, 以捕获的亚细胞相互作用关键的表征和进一步发展的临床前药物标记荧光探针。随着最近在抗体基础上的细胞毒性药物传递系统的进展, 了解这些药物诱导在受体聚集和内化领域的变化是至关重要的。该协议利用了 ImageJ 的荧光免疫细胞化学和开放源斐济分布的良好方法, 其内置自相关和图像数学功能, 以执行空间图像相关性光谱学 (ICS)。该协议 quantitates 了标记受体的荧光强度作为共焦显微镜光束区域的函数。这为细胞表面的靶分子聚集状态提供了定量测量。这种方法的重点是静态细胞的特征, 有潜力扩展到时间调查的受体聚集。该协议提出了一种可访问的方法, 用于提供在细胞表面发生的聚类事件的量化, 利用已建立好的技术和非专业的成像设备。
Introduction
治疗性抗体的发展在治疗多种肿瘤类型1中表现出显著的成功。最近的进展, 抗体-药物共轭 (ADC) 作为细胞毒性化合物的传递机制, 扩大了了解抗体动态的要求: 细胞表面的受体相互作用2。在成功地靶向细胞表面受体的抗体后, 这些配合物可以诱导相似的聚集模式对在配体中观察到的那些: 抗体相互作用3。受体聚集的改变会诱发细胞膜的改变, 并导致受体的内化和细胞表面的去除。在抗体-药物共轭的背景下, 这一过程随后将细胞毒性有效载荷释放到内内涵体内, 随后形成细胞质, 从而有效地杀死细胞。
共焦显微镜提供了一种有效的方法来可视化这些重要的相互作用的抗体和他们的目标受体4。探讨靶分子在细胞表面聚集的变化本协议利用空间图像相关光谱学 (ICS) 技术5、6、7 对共焦显微图像进行后处理..
图像相关光谱学的基础是观察到空间荧光强度波动与标记结构的密度和聚集状态的关系。这种关系是在计算被捕获的图像5的空间自相关函数之后建立的。
图像相关光谱学的所有变体都需要对图像自相关进行计算。接着将此函数拟合为二维高斯曲线, 用于提取图像中包含的定量聚合状态参数。简单地说, 图像自相关的计算涉及将图像中包含的所有可能的像素对进行比较, 并计算两者之间相等的亮度。这是可视化为一个函数的距离和方向的像素分离8。
建立了图像相关谱的理论框架, 并由彼得森和智者等来定义。5,6. 在本议定书中, 在斐济/ImageJ 和电子表格应用程序中执行自相关计算, 可将强度波动空间自相关函数的基础描述为(Eq 1):
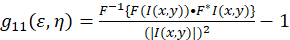
其中F代表傅立叶变换;F−1 逆傅里叶变换;F *其复杂共轭;和η的空间滞后变量。在空间集成电路中, 如本协议所述, 可使用2D 快速傅立叶变换算法7、9计算自相关函数。在零空间分离的自相关, 即零滞后, g11(00), 提供了显微镜下每束区域呈现的粒子的逆平均数。它可以通过将空间自相关函数拟合为二维高斯函数(Eq 2)来获得:
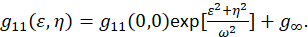
由于图像中捕获的像素包含在集合区域内, 而这些度量值不扩展到无穷大, 因此术语 g∞用作偏移量, 用于计算图像中包含的远距离空间相关性。对于分子大小的聚集体, ω是显微镜的点扩散函数, 由全宽半最大空间自相关函数描述。该仪器的点传播功能范围内, 可通过使用亚分辨率荧光珠校准。
对于本文所描述的图像相关光谱学协议, 使用开放源图像处理平台 (斐济10) 进行 ImageJ 的分布, 完成 ICS 所需的自相关和数学功能。节目11,12。斐济/ImageJ 在 FFT 数学函数中利用预安装的快速傅立叶变换。此函数通过在每个维度13中减小数据的范围, 从而减少了计算所需的计算时间。当2D 自相关函数在 x、y 轴上近似对称时, 通过自相关图像的单行剖面图可以用来测量原始自相关作为空间滞后的函数。在进一步计算之前, 任何零滞后噪声都将被移除, 由此产生的自相关振幅 (峰值、 g(0)T) 在表达式(Eq 3)的背景下得到修正:
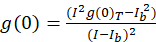
其中 Ib是来自背景区域的平均强度 (不包括单元格)。簇密度或荧光物体的密度是由(Eq 4)定义的:
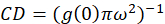
在本文所描述的协议中, 我们进一步简单地计算了聚类密度 (CD), 假设是在观测的基础上, 一个归一化的自相关函数将衰减到一个值接近1.0 的空间滞后。与最大空间滞后, 不再有任何相关性的荧光强度值, 因而没有相关的计算在这个区域计算的强度乘以这个强度, 随后除以那强度的正方形, 按定义是相等的到1.0。因此, 从归一化自相关函数的聚类密度可以计算在取其倒数(Eq 5)之前, 从规范化自相关函数中减去 1.0:
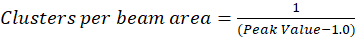
可以对光束区域进行进一步的标定, 以定量在该仪器的点传播函数区域内的簇数。这种校准必须使用相同的光学条件在图像相关光谱学分析中使用。
Protocol
Representative Results
Discussion
我们在本协议中描述的图像相关光谱学 (ICS) 技术使用标准共焦显微镜, 无需专门的探测器。ICS 技术描述利用已建立好的免疫细胞化学方法, 提供快速抽样的多种治疗条件, 以增加统计分析。这种方法这样做的绝对精度略有降低, 与替代单分子技术相比, 基于荧光波动的移动分子扩散通过共焦体积, 如荧光相关光谱学 (FCS)15。更专业的 FCS 方法还需要高灵敏度的光子计数探测器, 如雪?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
作者承认来自澳洲的资金支持 (奖学金1084178和赠款 1087850, 1030469, 1075898 (AMS)), 癌症澳大利亚, Ludwig 癌症研究, 约翰·里德信托, 治疗脑癌基金会, La 筹伯大学和维多利亚癌症机构。澳大利亚维多利亚政府提供的运营基础设施支持计划的资金也得到了承认。
Materials
| Nunc Lab-Tek II Chambered Coverglass – 8 well | ThermoFisher Scientific | 155409 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 10099141 | |
| TrypLE Express Enzyme (1x), no phenol red | ThermoFisher Scientific | 12604021 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | |
| Goat anti-Human IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 | ThermoFisher Scientific | A11013 | |
| TetraSpeck Fluorescent Microsphere Standards 0.1µm | ThermoFisher Scientific | T7279 | |
| Cetuximab | Merck Serono | 3023715501 | |
| Parafilm M 38mx100mm | Merck Millipore | BRND701605 | |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | ProSciTech | C004 | |
| Recombinant Human EGF | R&D System | 236-EG |
References
- Scott, A. M., Wolchok, J. D., Old, L. J. Antibody therapy of cancer. Nature reviews. Cancer. 12 (4), 278-287 (2012).
- Parslow, A. C., Parakh, S., Lee, F. -. T., Gan, H., Scott, A. Antibody-Drug Conjugates for Cancer Therapy. Biomedicines. 4 (3), 14 (2016).
- Sorkin, A., Waters, C. M. Endocytosis of growth factor receptors. BioEssays. 15 (6), 375-382 (1993).
- Pawley, J. . Handbook of Biological Confocal Microscopy. , (2006).
- Petersen, N. O., Höddelius, P. L., Wiseman, P. W., Seger, O., Magnusson, K. E. Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application. Biophysical Journal. 65 (3), 1135-1146 (1993).
- Wiseman, P. W., Petersen, N. O. Image Correlation Spectroscopy. II. Optimization for Ultrasensitive Detection of Preexisting Platelet-Derived Growth Factor-β Receptor Oligomers on Intact Cells. Biophysical Journal. 76 (2), 963-977 (1999).
- Costantino, S., Comeau, J. W. D., Kolin, D. L., Wiseman, P. W. Accuracy and Dynamic Range of Spatial Image Correlation and Cross-Correlation Spectroscopy. Biophysical Journal. 89 (2), 1251-1260 (2005).
- Claire Robertson, S. C. G. Theory and practical recommendations for autocorrelation-based image correlation spectroscopy. Journal of Biomedical Optics. 17 (8), 080801 (2012).
- Ciccotosto, G. D., Kozer, N., Chow, T. T. Y., Chon, J. W. M., Clayton, A. H. A. Aggregation Distributions on Cells Determined by Photobleaching Image Correlation Spectroscopy. Biophysical Journal. 104 (5), 1056-1064 (2013).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics International. 11 (7), 36-42 (2004).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43 (1 Suppl), 25-30 (2007).
- Rappaz, B., Wiseman, P. W. Image correlation spectroscopy for measurements of particle densities and colocalization. Current protocols in cell biology. , (2013).
- tferr/Scripts: BAR 1.5.1. Zenodo Available from: https://zenodo.org/record/495245 (2017)
- Elson, E. L. Fluorescence Correlation Spectroscopy: Past, Present, Future. Biophysical Journal. 101 (12), 2855-2870 (2011).
- Jares-Erijman, E. A., Jovin, T. M. Imaging molecular interactions in living cells by FRET microscopy. Current opinion in chemical biology. 10 (5), 409-416 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-Resolution Fluorescence Microscopy. dx.doi.org.ez.library.latrobe.edu.au. 78 (1), 993-1016 (2009).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Nohe, A., Petersen, N. O. Image Correlation Spectroscopy. Sci. Signal. (417), pl7 (2007).

