Modellering van een Enzyme Active Site met behulp van Moleculaire Visualisatie Freeware
Summary
Een belangrijke vaardigheid in biomoleculaire modellering is het weergeven en annoteren van actieve plaatsen in eiwitten. Deze techniek wordt gedemonstreerd met behulp van vier populaire gratis programma’s voor macromoleculaire visualisatie: iCn3D, Jmol, PyMOL en UCSF ChimeraX.
Abstract
Biomoleculaire visualisatievaardigheden zijn van het grootste belang voor het begrijpen van sleutelbegrippen in de biologische wetenschappen, zoals structuur-functierelaties en moleculaire interacties. Verschillende programma’s stellen een leerling in staat om 3D-structuren te manipuleren, en biomoleculaire modellering bevordert actief leren, bouwt computationele vaardigheden op en overbrugt de kloof tussen tweedimensionale tekstboekafbeeldingen en de drie dimensies van het leven. Een cruciale vaardigheid op dit gebied is om een eiwitactieve plaats te modelleren, waarbij delen van het macromolecuul worden weergegeven die kunnen interageren met een klein molecuul of ligand, op een manier die bindende interacties vertoont. In dit protocol beschrijven we dit proces met behulp van vier vrij beschikbare macromoleculaire modelleringsprogramma’s: iCn3D, Jmol / JSmol, PyMOL en UCSF ChimeraX. Deze gids is bedoeld voor studenten die de basisprincipes van een specifiek programma willen leren, evenals instructeurs die biomoleculaire modellering in hun curriculum opnemen. Het protocol stelt de gebruiker in staat om een actieve site te modelleren met behulp van een specifiek visualisatieprogramma, of om een voorbeeld te nemen van verschillende van de beschikbare gratis programma’s. Het model dat voor dit protocol is gekozen, is humaan glucokinase, een isovorm van het enzym hexokinase, dat de eerste stap van glycolyse katalyse katalyseert. Het enzym is gebonden aan een van zijn substraten, evenals een niet-reactief substraatanaloog, waarmee de gebruiker interacties in het katalytische complex kan analyseren.
Introduction
Het begrijpen van representaties van de moleculaire wereld is van cruciaal belang om een expert te worden in de biomoleculairewetenschappen 1, omdat de interpretatie van dergelijke beelden de sleutel is tot het begrijpen van de biologische functie2. De inleiding van een leerling tot macromoleculen komt meestal in de vorm van tweedimensionale leerboekafbeeldingen van celmembranen, organellen, macromoleculen, enz., Maar de biologische realiteit is dat dit driedimensionale structuren zijn, en een goed begrip van hun eigenschappen vereist manieren om betekenis te visualiseren en te extraheren uit 3D-modellen.
Dienovereenkomstig heeft de ontwikkeling van biomoleculaire visuele geletterdheid in hogere divisie moleculaire life science-cursussen aandacht gekregen, met een aantal artikelen die rapporteren over het belang en de moeilijkheden van het onderwijzen en beoordelen van visualisatievaardigheden1,3,4,5,6,7,8,9 . De reactie op deze artikelen is een toename van het aantal klassikale interventies, meestal binnen een semester in een enkele instelling, waarbij moleculaire visualisatieprogramma’s en -modellen worden gebruikt om moeilijke concepten te targeten2,10,11,12,13,14,15 . Daarnaast hebben onderzoekers geprobeerd te karakteriseren hoe studenten biomoleculaire visualisatieprogramma’s en / of modellen gebruiken om een specifiek onderwerp16,17,18,19te benaderen. Onze eigen groep, BioMolViz, heeft een raamwerk beschreven dat overkoepelende thema’s in visuele geletterdheid onderverdeelt in leerdoelen en doelstellingen om dergelijke interventies te begeleiden20,21,en we leiden workshops die faculteiten trainen om het kader te gebruiken in het achterwaartse ontwerp van beoordelingen om visuele geletterdheidsvaardigheden te meten22.
Centraal in al dit werk staat een kritische vaardigheid: het vermogen om structuren van macromoleculen te manipuleren met behulp van programma’s voor biomoleculaire visualisatie. Deze tools zijn onafhankelijk ontwikkeld met behulp van verschillende platforms; daarom kunnen ze vrij uniek zijn in hun werking en gebruik. Dit vereist programmaspecifieke instructies en de identificatie van een programma waarmee een gebruiker vertrouwd is, is belangrijk om de verdere implementatie te vergemakkelijken.
Naast de basisprincipes van het manipuleren van structuren in 3D (roteren, selecteren en wijzigen van het model), is een belangrijk doel om de actieve plaats van een eiwit te modelleren. Dit proces stelt een leerling in staat om zijn begrip te ontwikkelen in drie overkoepelende thema’s beschreven door het BioMolViz Framework: moleculaire interacties, liganden / modificaties en structuur-functierelaties20,21.
Vier populaire keuzes van programma’s voor biomoleculaire visualisatie zijn: Jmol / JSmol23,iCn3D24,PyMOL25en UCSF Chimera26,27. We moedigen degenen die nieuw zijn bij Chimera aan om UCSF ChimeraX te gebruiken, de volgende generatie van het Chimera moleculaire visualisatieprogramma, de momenteel ondersteunde versie van het programma.
In dit protocol laten we zien hoe we elk van deze vier programma’s kunnen gebruiken om de actieve plaats van menselijk glucokinase te modelleren met een gebonden substraat analoog complex (PDB ID: 3FGU), en om metingen weer te geven om specifieke bindingsinteracties te illustreren28. Het model vertegenwoordigt een katalytisch complex van het enzym. Om de actieve plaats in de prekatalysetoestand vast te leggen, werd een niet-hydrolyseerbaar analoog van ATP gebonden aan de actieve glucokinase-plaats. Deze fosfoaminofosfonzuur-adenylaatester (ANP) bevat een fosfor-stikstofbinding in plaats van de gebruikelijke fosfor-zuurstofkoppeling op deze positie. De actieve site bevat ook glucose (aangeduid met BCG in het model) en magnesium (aangeduid met MG). Bovendien is er een kaliumion (K) in de structuur, als gevolg van kaliumchloride dat wordt gebruikt in het kristallisatie-oplosmiddel. Dit ion is niet kritisch voor de biologische functie en bevindt zich buiten de actieve plaats.
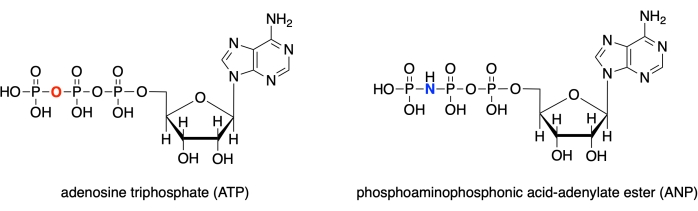
Figuur 1: ATP/ANP structuren. Adenosinetrifosfaat (ATP) structuur vergeleken met de fosfoaminofosfonzuur-adenylaat ester (ANP). Klik hier om een grotere versie van deze figuur te bekijken.
Het protocol toont de selectie van de gebonden liganden van het substraat analoog complex en de identificatie van actieve-site residuen binnen 5 Å van het gebonden complex, dat aminozuren en watermoleculen vangt die in staat zijn om relevante moleculaire interacties te maken, waaronder hydrofobe en van der Waals interacties.
De weergave wordt in eerste instantie gemanipuleerd om het grootste deel van het eiwit in een cartoonweergave weer te geven, met de aminozuurresiduen van de actieve plaats in stokweergave om de relevante atomen van het eiwit te tonen en de moleculaire interacties te benadrukken. Na stap 3 van het protocol voor elk programma zijn deze representaties toegepast en is de weergave van het eiwit vergelijkbaar tussen programma’s(figuur 2). Aan het einde van het protocol is de eiwitcartoon verborgen om de weergave te vereenvoudigen en zich te concentreren op de actieve site.
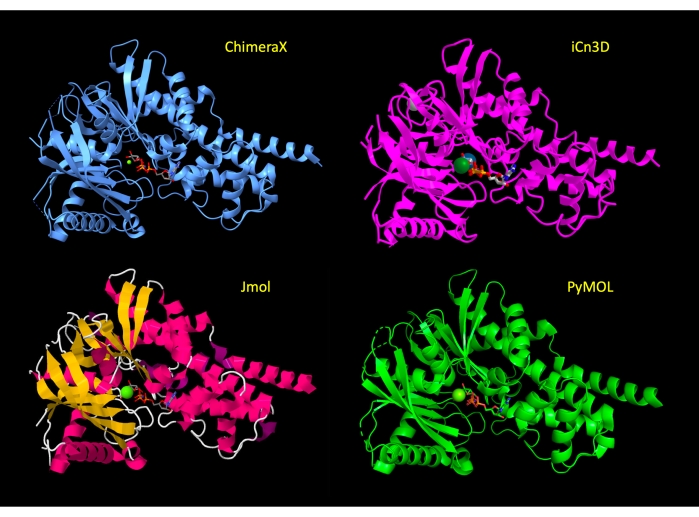
Figuur 2: Structuurvergelijking tussen programma’s. Vergelijking van de structuur van 3FGU in elk programma volgens de stap De representatie aanpassen (stap 2 of 3 van elk protocol). Klik hier om een grotere versie van deze figuur te bekijken.
CPK-kleuring wordt toegepast op de actieve plaats aminozuren en gebonden liganden29,30. Dit kleurschema onderscheidt atomen van verschillende chemische elementen in moleculaire modellen die worden weergegeven in lijn-, stok-, bal- en stok- en ruimtevullende representaties. Waterstof is wit, stikstof is blauw, zuurstof is rood, zwavel is geel en fosfor is oranje in het CPK-kleurenschema. Traditioneel wordt zwart gebruikt voor koolstof, hoewel in modern gebruik de koolstofkleuring kan variëren.
Waterstofatomen zijn niet zichtbaar in kristalstructuren, hoewel elk van deze programma’s in staat is om hun locatie te voorspellen. Het toevoegen van de waterstofatomen aan een grote macromoleculaire structuur kan het zicht vertroebelen, dus ze worden niet weergegeven in dit protocol. Dienovereenkomstig zullen waterstofbruggen worden getoond door te meten vanuit het midden van twee heteroatomen (bijv. Zuurstof naar zuurstof, zuurstof naar stikstof) in deze structuren.
Programma Overzichten
Downloadbare grafische gebruikersinterfaces (GUI’s): PyMOL (versie 2.4.1), ChimeraX (versie 1.2.5) en Jmol (versie 1.8.0_301) zijn gui-gebaseerde moleculaire modelleringstools. Deze drie interfaces zijn voorzien van opdrachtregels om getypte code in te voeren; veel van dezelfde mogelijkheden zijn beschikbaar via menu’s en knoppen in de GUI. Een gemeenschappelijk kenmerk in de opdrachtregel van deze programma’s is dat de gebruiker eerdere opdrachten kan laden en opnieuw kan uitvoeren met behulp van de pijltoetsen omhoog en omlaag op het toetsenbord.
Webgebaseerde GUI’s: iCn3D (I-see-in-3D) is een WebGL-gebaseerde viewer voor interactieve weergave van driedimensionale macromoleculaire structuren en chemicaliën op het web, zonder dat u een afzonderlijke toepassing hoeft te installeren. Het maakt geen gebruik van een opdrachtregel, hoewel de volledige webversie een bewerkbaar opdrachtlogboek bevat. JSmol is een JavaScript- of HTML5-versie van Jmol voor gebruik op een website of in een webbrowservenster en lijkt qua werking sterk op Jmol. JSmol kan worden gebruikt om online tutorials te maken, inclusief animaties.
Proteopedia31,32, FirstGlance in Jmol33en de JSmol-webinterface (JUDE) aan de Milwaukee School of Engineering Center for BioMolecular Modeling zijn voorbeelden van dergelijke Jmol-gebaseerde online ontwerpomgevingen34. De Proteopedia wiki is een leermiddel waarmee de gebruiker een macromolecuulstructuur kan modelleren en pagina’s met deze modellen kan maken binnen de website35. De Proteopedia scene authoring tool, gebouwd met behulp van JSmol, integreert een GUI met extra functies die niet beschikbaar zijn in de Jmol GUI.
Jmol en iCn3D zijn gebaseerd op de programmeertaal Java; JSmol gebruikt Java of HTML5 en PyMOL en ChimeraX zijn gebaseerd op de programmeertaal Python. Elk van deze programma’s laadt eiwitgegevensbankbestanden, die kunnen worden gedownload van de RCSB Protein Data Bank onder een 4-cijferige alfanumerieke PDB ID36,37. De meest voorkomende bestandstypen zijn Protein Data Bank (PDB)-bestanden met de extensie .pdb en Crystallographic Information File (CIF of mmCIF) met de extensie .cif. CIF heeft PDB vervangen als het standaardbestandstype voor de Protein Data Bank, maar beide bestandsindelingen werken in deze programma’s. Er kunnen kleine verschillen zijn in de manier waarop de volgorde/structuur wordt weergegeven bij het gebruik van CIF in tegenstelling tot PDB-bestanden; de bestanden werken echter op dezelfde manier en de verschillen zullen hier niet in detail worden behandeld. De Molecular Modeling Database (MMDB), een product van het National Center for Biotechnology Information (NCBI), is een subset van VOB-structuren waaraan categorische informatie is gekoppeld (bijv. Biologische kenmerken, geconserveerde eiwitdomeinen)38. iCn3D, een product van de NCBI, is in staat om PDB-bestanden met de MMDB-gegevens te laden.
Om een model te bekijken, kan de gebruiker het gewenste bestand downloaden van de speciale pagina Eiwitgegevensbank voor de structuur (bijvoorbeeld https://www.rcsb.org/structure/3FGU) en vervolgens het vervolgkeuzemenu Bestand van het programma gebruiken om de structuur te openen. Alle programma’s zijn ook in staat om een structuurbestand rechtstreeks via de interface te laden, en die methode wordt gedetailleerd in de protocollen.
De ChimeraX-, Jmol- en PyMOL-GUI’s bevatten elk een of meer vensters van de console die kunnen worden gewijzigd door de hoek te slepen. iCn3D en JSmol bevinden zich volledig in een webbrowser. Wanneer u iCn3D gebruikt, moet de gebruiker mogelijk in de pop-upvensters scrollen om alle menu-items weer te geven, afhankelijk van de schermgrootte en resolutie.
De protocollen die hier worden beschreven, bieden een eenvoudige methode om de actieve plaats van het enzym weer te geven met behulp van elk programma. Opgemerkt moet worden dat er meerdere manieren zijn om de stappen in elk programma uit te voeren. In ChimeraX kan dezelfde taak bijvoorbeeld worden uitgevoerd met behulp van vervolgkeuzemenu’s, de werkbalk bovenaan of de opdrachtregel. Gebruikers die geïnteresseerd zijn in het leren van een specifiek programma in detail worden aangemoedigd om de online tutorials, handleidingen en Wiki’s te verkennen die beschikbaar zijn voor deze programma’s39,40,41,42,43,44,45,46.
Bestaande handleidingen en zelfstudies voor deze programma’s presenteren de items in dit protocol als afzonderlijke taken. Om een actieve site weer te geven, moet de gebruiker de vereiste bewerkingen synthetiseren uit de verschillende handleidingen en zelfstudies. Dit manuscript vormt een aanvulling op bestaande zelfstudies die beschikbaar zijn door een lineair protocol te presenteren voor het modelleren van een gelabelde actieve site met moleculaire interacties, waardoor de gebruiker een logica krijgt voor actieve sitemodellering die kan worden toegepast op andere modellen en programma’s.
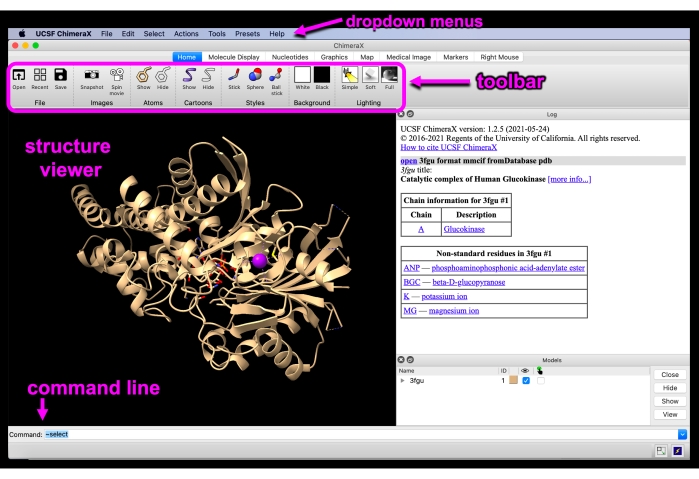
Figuur 3: Chimerax GUI. ChimeraX GUI-interface met de vervolgkeuzemenu’s, werkbalk, structuurviewer en opdrachtregel gelabeld. Klik hier om een grotere versie van deze figuur te bekijken.
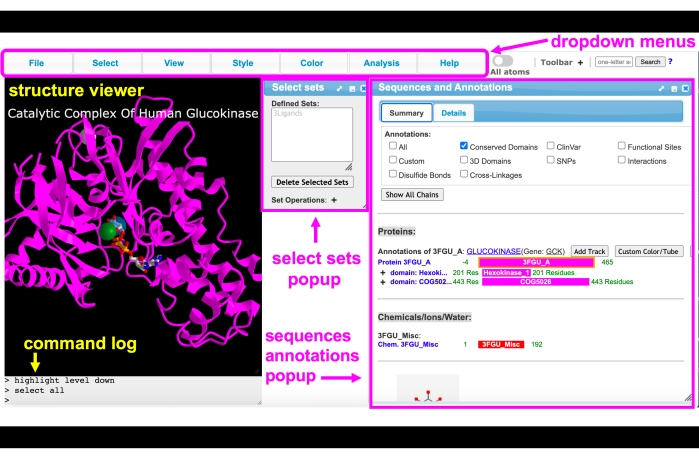
Afbeelding 4: iCn3D GUI. iCn3D GUI-interface met de vervolgkeuzemenu’s, werkbalk, structuurviewer, opdrachtlogboek, pop-up van geselecteerde sets en pop-upmenu’s met volgorde en annotaties gelabeld. Klik hier om een grotere versie van deze figuur te bekijken.
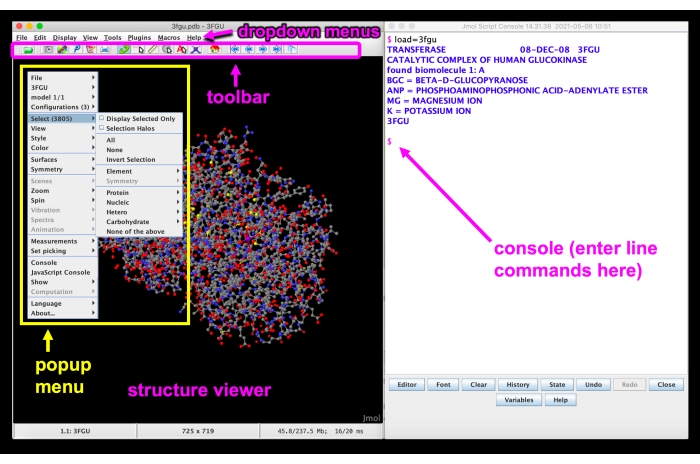
Figuur 5: Jmol GUI. Jmol GUI-interface met de vervolgkeuzemenu’s, werkbalk, structuurviewer, pop-upmenu en console / opdrachtregel gelabeld. Klik hier om een grotere versie van deze figuur te bekijken.

Figuur 6: PyMOL GUI. PyMOL GUI-interface met de vervolgkeuzemenu’s, structuurviewer, namen / objectpaneel, muisbedieningsmenu en opdrachtregel gelabeld. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Dit protocol schetst een tienstappenproces voor de modellering van een enzymactieve site, toegepast op vier populaire programma’s voor biomoleculaire modellering. De kritieke stappen van het protocol zijn: het identificeren van de liganden op de actieve plaats, het selecteren van residuen binnen 5 Å om een actieve plaats te definiëren en het tonen van de interacties van het enzym met de actieve plaats liganden. Het onderscheiden van de liganden die relevant zijn voor de biologische functie is van het grootste belang, omdat dit de gebruiker in staat stelt om de aminozuurresiduen binnen 5 Å te definiëren die een rol kunnen spelen bij het binden van de liganden. Ten slotte stelt het gebruik van het programma om moleculaire interacties weer te geven de gebruiker in staat om de vaardigheden te ontwikkelen die nodig zijn om de moleculaire interacties te begrijpen die binding bevorderen.
Een beperking van computergebaseerde moleculaire modelleringsprotocollen is de afhankelijkheid van specifieke opdrachten en syntaxis. Hoewel biochemische protocollen tolerant kunnen zijn voor kleine veranderingen in de procedure, kunnen computergebaseerde onderzoeken enorm verschillende eindproducten opleveren als de procedure niet nauw wordt nageleefd. Dit is met name belangrijk bij het gebruik van opdrachtregelinterfaces waarbij programmaspecifieke syntaxis vereist is om een bepaalde uitvoer te bereiken, en een schijnbaar onbeduidende wijziging in interpunctie of hoofdlettergebruik kan ertoe leiden dat een opdracht mislukt. Er zijn verschillende Wiki’s en handleidingen voor elk programma, waar een gebruiker opdrachtregelinvoer kan vinden en problemen kan oplossen; de gebruiker moet zorgvuldig letten op de details van de opdrachtsyntaxis. Hoewel de meeste moleculaire visualisatieprogramma’s opdrachten ongedaan maken bevatten, vanwege de complexiteit van de interfaces, keert het ongedaan maken commando niet altijd getrouw de laatst uitgevoerde stap om. Daarom wordt het opslaan van de huidige werkstatus vaak aangemoedigd, vooral voor nieuwe gebruikers.
Verdere beperkingen kunnen voortvloeien uit de gegevens die worden gebruikt om het model zelf te maken. Hoewel de standaarden die inherent zijn aan de Protein Data Bank zorgen voor een zekere mate van consistentie, zullen gebruikers van moleculaire visualisatieprogramma’s vaak onverwachte effecten tegenkomen in een eiwitweergave. Ten eerste worden de meeste structuren bepaald met behulp van röntgenkristallografie, die een enkel model van het eiwit biedt; NMR-structuren zijn echter vaak samengesteld uit meerdere modellen die één voor één kunnen worden gevisualiseerd. Ten tweede kunnen structuren bepaald op basis van kristallografie of cryogene elektronenmicroscopie-experimenten atomen bevatten waarvan de positie niet kan worden opgehelderd en verschijnen als hiaten in bepaalde representaties van het eiwit. Eiwitstructuren kunnen alternatieve conformaties van zijketens hebben, die, wanneer weergegeven in stick rendering, verschijnen als twee groepen die uit dezelfde aminozuurruggegraat steken. Zelfs korte delen van de ruggengraat kunnen dergelijke alternatieve conformaties hebben, en soms worden liganden in de actieve plaats in meer dan één bindende conformatie gesuperponeerd.
Voor een kristalstructuur omvatten de gedeponeerde 3D-coördinaten alle componenten van de asymmetrische eenheid, die voldoende informatie biedt om de herhalende eenheid van een eiwitkristal te reproduceren. Soms bevat deze structuur extra eiwitketens in vergelijking met de biologisch actieve vorm van het eiwit (bijv. Foetale hemoglobinemutant, PDB ID: 4MQK). Omgekeerd laden sommige programma’s mogelijk niet automatisch alle ketens van de biologisch actieve eenheid. Het SARS-CoV2-hoofdprotease (PDB ID: 6Y2E) laadt bijvoorbeeld de helft van het biologisch actieve dimeer (bestaande uit twee eiwitketens) wanneer het wordt opgehaald met behulp van de commando’s die in dit protocol worden beschreven in ChimeraX, PyMOL en Jmol. Hoewel een kleine wijziging van het commando het biologisch actieve dimeer zal laden, is deze overweging mogelijk niet eenvoudig voor de beginnende gebruiker van het modelleringsprogramma. Een ander probleem dat zich kan voordoen, is de identificatie van de actieve locatie of het substraat zelf. Kristallografische experimenten worden uitgevoerd met behulp van een verscheidenheid aan moleculen, die kunnen worden gemodelleerd in de uiteindelijke structuur. Sulfaatmoleculen kunnen bijvoorbeeld fosfaatbindende plaatsen in de actieve site binden, of ze kunnen andere regio’s binden die niet relevant zijn voor het mechanisme. Deze moleculen kunnen de juiste identificatie van de actieve site zelf verdoezelen en kunnen zelfs aan de student suggereren dat ze deel uitmaken van het mechanisme.
Vermoedelijk zal de gebruiker deze procedure willen toepassen op andere actieve/bindende sites. Om dit protocol toe te passen in de toekomstige werkzaamheden met betrekking tot de analyse van nieuwe eiwitactieve plaatsen, moet de gebruiker identificeren welke van de gebonden liganden relevant zijn om te functioneren. Sommige liganden zijn niet geassocieerd met de eiwitfunctie en zijn in plaats daarvan het resultaat van de oplosmiddel- of kristallisatieomstandigheden die worden gebruikt om het experiment uit te voeren (bijvoorbeeld het kaliumion dat aanwezig is in het 3FGU-model). De belangrijkste liganden moeten worden geïdentificeerd door het originele manuscript te raadplegen. Met oefening en, indien van toepassing, een goed begrip van de syntaxis van de regelopdracht, kan een gebruiker het protocol voor het gewenste modelleringsprogramma toepassen op elke enzymactieve site en andere macromoleculen van zijn keuze modelleren.
Het identificeren en analyseren van gebonden substraten en liganden staat centraal in de opheldering van moleculaire mechanismen en op structuur gebaseerde inspanningen voor het ontwerpen van geneesmiddelen, die direct hebben geleid tot verbeteringen in behandelingen voor ziekten, waaronder verworven immunodeficiëntiesyndroom (AIDS) enCOVID-19 47,48,49,50,51,52 . Hoewel individuele moleculaire visualisatieprogramma’s verschillende interfaces en gebruikerservaringen bieden, bieden de meeste vergelijkbare functies. Het is belangrijk voor de ontwikkeling van biomoleculaire visualisatiegeletterdheid dat studenten biochemie op het hoogste niveau vertrouwd raken met structuurvisualisatie en de hulpmiddelen om dergelijke afbeeldingen te genereren4,20,53. Dit stelt studenten in staat om verder te gaan dan de interpretatie van tweedimensionale afbeeldingen in studieboeken en tijdschriftartikelen en om gemakkelijker hun eigen hypothesen te ontwikkelen uit structurele gegevens54, die ontwikkelende wetenschappers zullen voorbereiden om toekomstige volksgezondheidsproblemen aan te pakken en het begrip van biochemische processen te verbeteren.
Samenvattend beschrijft dit protocol actieve sitemodellering met behulp van vier toonaangevende gratis macromoleculaire modelleringsprogramma’s. Onze community, BioMolViz, hanteert een niet-softwarespecifieke benadering van biomoleculaire modellering. We hebben specifiek een kritiek of vergelijking van programmafuncties vermeden, hoewel een gebruiker die elk programma bemonstert waarschijnlijk zal merken dat ze de voorkeur geven aan bepaalde aspecten van macromoleculaire modellering in het ene programma versus het andere. We nodigen lezers uit om het BioMolViz Framework te gebruiken, dat de op biomoleculaire visualisatie gebaseerde leerdoelen en -doelstellingen beschrijft die in dit protocol zijn gericht, en bronnen te verkennen voor het onderwijzen en leren van biomoleculaire visualisatie via de BioMolViz-communitywebsite op http://biomolviz.org.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Financiering voor dit werk is verstrekt door de National Science Foundation:
Verbetering van de Undergraduate STEM Education Grant (Award #1712268)
Onderzoekscoördinatienetwerken in undergraduate in undergraduate biologieonderwijs (Award # 1920270)
We zijn Karsten Theis, PhD, Westfield University, dankbaar voor de nuttige discussies over Jmol.
Materials
| ChimeraX (Version 1.2.5) https://www.rbvi.ucsf.edu/chimerax/ | |||
| Computer | Any | ||
| iCn3D (web-based only: https://www.ncbi.nlm.nih.gov/Structure/icn3d/full.html) | |||
| Java (for Jmol) https://java.com/en/download/ | |||
| Jmol (Version 1.8.0_301) http://jmol.sourceforge.net/ | |||
| Mouse (optional) | Any | ||
| PyMOL (Version 2.4.1 – educational): https://pymol.org/2 educational use only version: https://pymol.org/edu/?q=educational |
References
- Loertscher, J., Green, D., Lewis, J. E., Lin, S., Minderhout, V. Identification of threshold concepts for biochemistry. CBE Life Sciences Education. 13 (3), 516-528 (2014).
- Jaswal, S. S., O’Hara, P. B., Williamson, P. L., Springer, A. L. Teaching structure: Student use of software tools for understanding macromolecular structure in an undergraduate biochemistry course: Teaching structure in undergraduate biochemistry. Biochemistry and Molecular Biology Education. 41 (5), 351-359 (2013).
- Tibell, L. A. E., Rundgren, C. -. J. Educational challenges of molecular life science: Characteristics and implications for education and research. CBE Life Sciences Education. 9 (1), 25-33 (2010).
- Schönborn, K. J., Anderson, T. R. The importance of visual literacy in the education of biochemists. Biochemistry and Molecular Biology Education. 34 (2), 94-102 (2006).
- Anderson, T. R. Bridging the educational research-teaching practice gap: The importance of bridging the gap between science education research and its application in biochemistry teaching and learning: Barriers and strategies. Biochemistry and Molecular Biology Education. 35 (6), 465-470 (2007).
- Schönborn, K. J., Anderson, T. R. Bridging the educational research-teaching practice gap: Foundations for assessing and developing biochemistry students’ visual literacy. Biochemistry and Molecular Biology Education. 38 (5), 347-354 (2010).
- Bateman, R. C., Craig, P. A. Education corner: A proficiency rubric for biomacromolecular 3D literacy. PDB Newsletter. 45, 5-7 (2010).
- Mnguni, L., Schönborn, K., Anderson, T. Assessment of visualization skills in biochemistry students. South African Journal of Science. 112, 1-8 (2016).
- Craig, P. A., Michel, L. V., Bateman, R. C. A survey of educational uses of molecular visualization freeware. Biochemistry and Molecular Biology Education. 41 (3), 193-205 (2013).
- Loertscher, J., Villafañe, S. M., Lewis, J. E., Minderhout, V. Probing and improving student’s understanding of protein α-Helix structure using targeted assessment and classroom interventions in collaboration with a faculty community of practice. Biochemistry and Molecular Biology Education. 42 (3), 213-223 (2014).
- Abualia, M., et al. Connecting protein structure to intermolecular interactions: A computer modeling laboratory. Journal of Chemical Education. 93 (8), 1353-1363 (2016).
- Carvalho, I., Borges, A. D. L., Bernardes, L. S. C. Medicinal chemistry and molecular modeling: An integration to teach drug structure–activity relationship and the molecular basis of drug action. Journal of Chemical Education. 82 (4), 588 (2005).
- Forbes-Lorman, R. M., et al. Physical models have gender-specific effects on student understanding of protein structure-function relationships. Biochemistry and Molecular Biology Education. 44 (4), 326-335 (2016).
- Terrell, C. R., Listenberger, L. L. Using molecular visualization to explore protein structure and function and enhance student facility with computational tools. Biochemistry and Molecular Biology Education. 45 (4), 318-328 (2017).
- Zhang, S., et al. Structure-based drug design of an inhibitor of the SARS-CoV-2 (COVID-19) main protease using free software: A tutorial for students and scientists. European Journal of Medicinal Chemistry. 113390, (2021).
- Roberts, J. R., Hagedorn, E., Dillenburg, P., Patrick, M., Herman, T. Physical models enhance molecular three-dimensional literacy in an introductory biochemistry course. Biochemistry and Molecular Biology Education. 33 (2), 105-110 (2005).
- Jenkinson, J., McGill, G. Visualizing protein interactions and dynamics: Evolving a visual language for molecular animation. CBE Life Sciences Education. 11 (1), 103-110 (2012).
- Bussey, T. J., Orgill, M. What do biochemistry students pay attention to in external representations of protein translation? The case of the Shine–Dalgarno sequence. Chemistry Education Research and Practice. 16 (4), 714-730 (2015).
- Harle, M., Towns, M. H. Students’ understanding of primary and secondary protein structure: Drawing secondary protein structure reveals student understanding better than simple recognition of structures. Biochemistry and Molecular Biology Education. 41 (6), 369-376 (2013).
- Dries, D. R., et al. An expanded framework for biomolecular visualization in the classroom: Learning goals and competencies. Biochemistry and Molecular Biology Education. 45 (1), 69-75 (2017).
- Procko, K., et al. Meeting report: BioMolViz workshops for developing assessments of biomolecular visual literacy. Biochemistry and Molecular Biology Education. 49 (2), 278-286 (2021).
- Wang, J., et al. iCn3D, a web-based 3D viewer for sharing 1D/2D/3D representations of biomolecular structures. Bioinformatics. 36 (1), 131-135 (2020).
- PyMOL . . The PyMOL Molecular Graphics System. Version 2.0. , (2021).
- Goddard, T. D., et al. UCSF ChimeraX: Meeting modern challenges in visualization and analysis. Protein Science. 27 (1), 14-25 (2018).
- Pettersen, E. F., et al. UCSF ChimeraX: Structure visualization for researchers, educators, and developers. Protein Science. 30 (1), 70-82 (2021).
- Petit, P., et al. The active conformation of human glucokinase is not altered by allosteric activators. Acta Crystallographica. Section D. 67 (11), 929-935 (2011).
- Corey, R. B., Pauling, L. Molecular models of amino acids, peptides and proteins. Review of Scientific Instruments. 24, 621-627 (1953).
- Koltun, W. L. Precision space-filling atomic models. Biopolymers. 3 (6), 665-679 (1965).
- Hodis, E., et al. Proteopedia – a scientific ‘wiki’ bridging the rift between three-dimensional structure and function of biomacromolecules. Genome Biology. 9 (8), 1-10 (2008).
- Prilusky, J., et al. Proteopedia: A status report on the collaborative, 3D web-encyclopedia of proteins and other biomolecules. Journal of Structural Biology. 175 (2), 244-252 (2011).
- . FirstGlance in Jmol Available from: https://www.bioinformatics.org/firstglance/fgij/ (2021)
- Jmol User Design Environment (JUDE). MSOE Centerfor BioMolecular Modeling Available from: https://cbm.msoe.edu/modelingResources/jmolUserDesignEnvironment/#forward (2021)
- Castro, C. R., et al. A practical guide to teaching with Proteopedia. Biochemistry and Molecular Biology Education. 49 (5), 707-719 (2021).
- Berman, H. M., et al. The protein data bank. Nucleic Acids Research. 28, 235-242 (2000).
- . The Protein Data Bank Available from: https://www.rcsb.org/ (2021)
- Wang, Y., et al. MMDB: 3D structure data in Entrez. Nucleic Acids Research. 28 (1), 243-245 (2000).
- . iCn3D Help Page Available from: https://www.ncbi.nlm.nih.gov/Structure/icn3d/docs/icn3d_help.html (2021)
- . MSOE Center for BioMolecular Modeling Jmol Training Guide Available from: https://cbm.msoe.edu/modelingResources/jmolTrainingGuide/started.html (2021)
- . Jmol/JSmol Interactive Scripting Documentation Available from: https://chemapps.stolaf.edu/jmol/docs/ (2021)
- . PyMOL Wiki Available from: https://pymolwiki.org/index.php/Main_Page (2021)
- . PyMOL Advanced Scripting Workshop by Schrödinger Available from: https://pymol.org/tutorials/scripting/index.html (2021)
- . UCSF ChimeraX User Guide Available from: https://www.cgl.ucsf.edu/chimerax/docs/user/index.html (2021)
- . UCSF ChimeraX Tutorials Available from: https://www.rbvi.ucsf.edu/chimerax/tutorials.html (2021)
- Kuntz, I. D. Structure-based strategies for drug design and discovery. Science. 257 (5073), 1078-1082 (1992).
- Hubbard, R. E. . Structure-based drug discovery: an overview. , (2006).
- Patrick, G. L. . An introduction to medicinal chemistry, 6th ed. , (2017).
- Van Montfort, R. L., Workman, P. Structure-based drug design: aiming for a perfect fit. Essays in Biochemistry. 61 (5), 431-437 (2017).
- Holdgate, G. A., Meek, T. D., Grimley, R. L. Mechanistic enzymology in drug discovery: a fresh perspective. Nature Reviews. Drug Discovery. 17 (2), 115-132 (2018).
- Wang, M. Y., et al. SARS-CoV-2: structure, biology, and structure-based therapeutics development. Frontiers in Cellular and Infection Microbiology. 10, (2020).
- White, B., Kim, S., Sherman, K., Weber, N. Evaluation of molecular visualization software for teaching protein structure differing outcomes from lecture and lab: Differing outcomes from lecture and lab. Biochemistry and Molecular Biology Education. 30 (2), 130-136 (2002).
- Canning, D. R., Cox, J. R. Teaching the structural nature of biological molecules: Molecular visualization in the classroom and in the hands of students. Chemistry Education Research and Practice. 2 (2), 109-122 (2001).

