使用介电泳分离珠和多通道微流控芯片细胞和层流
Summary
介电泳(DEP)是一种有效的方法操纵细胞。无接触的细胞在微流体装置操作,印刷电路板(PCB),可以提供价格低廉,可重复使用的和有效的电极。 PCB上的盖玻片相结合为基础的PDMS微流体通道,我们展示了多通道微流控装置内珠和细胞的操纵和分离。
Abstract
拥有先进的微流体装置上规模的细胞研究,处理,分类和计数细胞提供一个充满活力的流体环境的细胞研究。然而,操纵细胞内的流体域仍然是一个挑战,需要复杂的制造协议,形成阀和电极,或要求光镊等专业设备。在这里,我们表明,传统的印刷电路板(PCB),可用于细胞的非接触式操纵用人bioactuation珠和细胞层流场操纵介(DEP),并在多通道微分离细胞和珠设备。首先,我们目前的协议,用于组装的DEP电极和微流体装置,并准备DEP的细胞。然后,我们描述了与聚苯乙烯珠DEP的操作。最后,我们代表结果表明珠和细胞分离在一个多通道的微流体装置。总之,DEP是一个有效的方法,用于操纵微流体装置内的粒子(珠或细胞)。
Protocol
Discussion
细胞在微流体装置的操作是可取的排序或单个细胞的选择性安置或2层流人口研究。阀门和泵结合使用,操纵细胞在微流体装置。但是,这些方法是具有挑战性的,需要进行详细的制造工艺和技能3离心可以简化为单元布局,但同时成像是一个挑战的要求。此外,离心通道架构必须审慎考虑在设计时所需的操作,并考虑影响4个激光镊子可用于细胞的位置,但方法是昂贵,不适合用于高通量细胞分选5然而,向心力。DEP已被证明有效的制度,作为“电镊”,为有效的细胞安置,表征和操纵。6,7
具体来说,环境保护署署长已用于片上处理生活和死亡的细胞,7-10和细胞质量的测量谐振传感器收集细胞的细胞有选择性地捕捉和排序11。之前我们已经证实增加的DEP细菌或以上的流体拖曳力珠的力量,片上的集中和聚苯乙烯粒单核细胞增生李斯特菌和V7诱捕可以 完成 12大肠杆菌混合种群大肠杆菌和L。指示菌的细菌也可通过DEP的脉冲释放。此外,较大的颗粒,可差异捕获并主要集中在基于大颗粒大小的电极,而更小的粒子都无法捕捉,但与流体流动删除13。DEP时势力不克服流体拖曳力的粒子,珠或细胞无法捕捉的,而是内流体流。如在图2C所示,珠子可以集中到足够的液体流保留在中央通道的珠中部地区。这可能是由于粒子粒子影响的综合效应,内电场流速大于拖动DEP的力量,这些组合,或其他一些不确定的效果。
接触的DEP新的进步使得 1,9接触的DEP提供的承诺,整理,收集和定位细胞微流体社会所需的最低场细胞的捕获和操纵,从而保护细胞类型,在最大程度上,在DEP的操作,最大限度地提高。在微流体装置。我们预计,随着需求的增加,并在微流体装置,进一步发现和创新的操作实施,环境保护署署长将扩大DEP的力量的理解和影响。
可以通过高容量的过程制造多氯联苯在一个合理的价格与快速制造的周转时间,使他们良好的商业化平台。此外,多氯联苯,易于使用和访问片上的细胞操作和排序的学科范围的科学家。
设计的印刷电路板电极的布局时,应考虑到所需的颗粒/细胞的运动轨迹。考虑的主要因素包括颗粒大小和类型(珠和/或细胞),细胞类型,微大小,流速,电极间距(这就决定了电场强度),盖玻片厚度,流体的电导率。这些因素的影响,所需的力和可供操作的粒子或细胞,并最终分离效率。我们这里介绍的协议表明,为有效启动微球和细胞分离的DEP设置。对于潜在的应用,用户应配合所需的细胞和珠子的流动路径,以及电极图案的微流体通道设计的结构优化为每个应用程序的效率。根据此前公布的指引,设计微流体通道布局时,电极间距和盖玻片厚度可用于1
细胞/粒子与周围介质的电导率和介电常数必须是不同的,足以促进积极或消极的DEP,同时保持细胞完好无损。 DEP的球形粒子的极性可确定真正从克劳修斯 – Mosotti DEP的电压频率ω以下因素的一个复杂的价值的一部分。
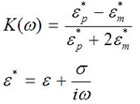
公式1
在这个方程ε是介电常数,σ是电导率,ε*是复介电常数。标P和M分别表示粒子和媒体。当一个细胞具有较高的介电常数比媒体,或克劳Mosotti因素的真正变为正值,颗粒变得比周围介质的极化。由于非均匀的电场,粒子的极化成为非均匀,这产生了积极的DEP(DEP)的力量,向着更高的电场强度区域的绘制细胞。如果一个单元有一个比周围介质的介电常数较低,或克劳修斯 – Mosotti因素变为负的实际部分,它将接受负的DEP(DEP)的细胞是被迫走向最小的场区。如果细胞和媒体有大致相同的复介电常数,没有任何力量可以产生操纵细胞。出于这个原因,纯净水是DEP粒子操纵的首选媒体。然而,以避免对纯净水的细胞渗透胁迫,低电导率介质是制定保持导电性不变,但增加的渗透压降低渗透胁迫的细胞。传统的细胞培养介质或生理的缓冲区,如DMEM或PBS,具有很高的导电性,这是不适合的DEP操纵。
我们也有先前表明,细胞可捕获与DEP使用低电导率介质传感器。细胞附着的一个短暂的时期之后,低电导率介质可以被替换为所需的细胞培养介质,支持天的细胞生长。11
从我们的经验,荧光珠与活细胞荧光非常明亮,因此它可以是一个挑战珠强度相匹配的生活和荧光细胞强度。为了提高可视化细胞和珠,我们使用了一个直立显微镜成像都DIC的显微镜。要显示细胞和珠中,我们提出的数据,在强度焕发规模的形象,它保留在很宽的彩色光谱数据为便于观看。因此,设计研究的兴趣时,成像参数和资源必须加以考虑。
总之,我们证明能够有选择性地驱动单独使用DEP的渠道珠和细胞。随着细胞生物学,生物化学,生物工程应用的微流体通道的增加实用工具,DEP是细胞采集,安置和整理的一个理想的选择。 PCB电极制造廉价和方便,易于使用的电极,快速的制作时间是理想的实施DEP的。
Offenlegungen
The authors have nothing to disclose.
Acknowledgements
他在设备安装的援助提供DEP的驱动和米切尔Collens trifurcating渠道,我们对此表示赞赏常宇晋。这项工作一直支持由美国国家科学基金会通过赠款OISE – 0951647,由台湾国科会通过批准99-2911-1-002-007。
Materials
| Material Name | Typ | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Sylgard 184 kit (PDMS) | Elsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard | |
| 16 awg hook-up wire | Belden | 8521 | (Type MW) Mil-W-76C-PVC | |
| Gold seal Cover Glass | Ted Pella | 260320 | No. 0 thick, 24 x 60 mm | |
| Miltex Biopsy Punch | VWR Scientific | 95039-104 | Miltex, assorted sizes | |
| Custom PCB electrodes | Bay Area Circuits | Custom parts | ||
| Mineral oil | Fisher Scientific | O121-1 | ||
| Deionized water | House DI water supply | None | Use filtered DI water | |
| D-Glucose Anhydrous Granular AR | Mallinckrodt Chemicals | 4912-06 | ||
| Sucrose, Crystal | Mallinckrodt Chemicals | 8360-06 | ||
| Fluorescent polymer microspheres | Bangs Laboratories | FS07F/9277 | 15μm Dragon green microspheres | |
| HT-29 cell line | ATCC | HTB-38D | Human colon adenocarcinoma | |
| Typsin 0.05% EDTA | Invitrogen | 25300054 | ||
| Eclipse E600FN upright microscope | Nikon | Eclipse E600FN | ||
| Phantom V310 High-speed imaging camera | Phantom | V310 | ||
| BX51 upright research microscope | Olympus | BX51 | ||
| SpotFlex high resolution color camera | Diagnostic Instruments | FX1520 | ||
| Function generator | Agilent | 3325A | ||
| RF Power amplifier | EIN | 2100L |
Referenzen
- Park, K., Suk, H. J., Akin, D. Dielectrophoresis-based cell manipulation using electrodes on a reusable printed circuit board. Lab Chip. 9, 2224-2224 (2009).
- Nilsson, J., Evander, M., Hammarstrom, B. et al., Review of cell and particle trapping in microfluidic systems. Anal. Chim. Acta. 649, 141-141 (2009).
- Fu, A. Y., Chou, H. P., Spence, C. An integrated microfabricated cell sorter. Anal. Chem. 74, 2451-2451 (2002).
- Rhee, S. W., Taylor, A. M., Cribbs, D. H. External force-assisted cell positioning inside microfluidic devices. Biomed. Microdevices. 9, 15-15 (2007).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. J. R. Soc. Interface. 5, 671-671 (2008).
- Hunt, T. P., Westervelt, R. M. Dielectrophoresis tweezers for single cell manipulation. Biomed. Microdevices. 8, 227-227 (2006).
- Vahey, M. D., Voldman, J. An equilibrium method for continuous-flow cell sorting using dielectrophoresis. Anal. Chem. 80, 3135-3135 (2008).
- Burgarella, S., Bianchessi, M., Merlo, S. A Modular Platform for Cell Characterization, Handling and Sorting by Dielectrophoresis. Cytometry A. 77A, 189-18 (2010).
- Shafiee, H., Sano, M. B., Henslee, E. A. Selective isolation of live/dead cells using contactless dielectrophoresis (cDEP). Lab Chip. 10, 438-438 (2010).
- Vahey, M. D., Voldman, J. High-Throughput Cell and Particle Characterization Using Isodielectric Separation. Anal. Chem. 81, 2446-2446 (2009).
- Park, K., Jang, J., Irimia, D. Living cantilever arrays’ for characterization of mass of single live cells in fluids. Lab Chip. 8, 1034-1034 (2008).
- Gomez-Sjoberg, R., Morisette, D. T., Bashir, R. Impedance microbiology-on-a-chip: Microfluidic bioprocessor for rapid detection of bacterial metabolism. J. Microelectromech. Syst. 14, 829-829 (2005).
- Li, H. B., Zheng, Y. N., Akin, D. Characterization and modeling of a microfluidic dielectrophoresis filter for biological species. J. Microelectromech. Syst. 14, 103-103 (2005).

