20.9:
結晶場理論 - 四面体及び平面四辺型錯体
20.9:
結晶場理論 - 四面体及び平面四辺型錯体
四面体型錯体
結晶場理論(CFT)は、八面体以外の幾何学的構造を持つ分子にも適用できます。八面体型錯体では、dx2−y2とdz2の軌道のローブが直接配位子の方を向いています。四面体型錯体の場合、d軌道はそのままですが、軸の間に4つの配位子だけが配置されています。どの軌道も四面体の配位子の方を直接向いていません。しかし、dx2− y2とdz2の軌道(直交軸に沿った軌道)は、dxy、dxz、dyzの軌道よりも配位子との重なりが少ません。八面体の場合との類似性から、四面体結晶場におけるd軌道のエネルギー図は、Figure 1のように予測できます。混乱を避けるため、八面体のeg表記は四面体のe表記となり、八面体のt2g表記はt2表記となります。
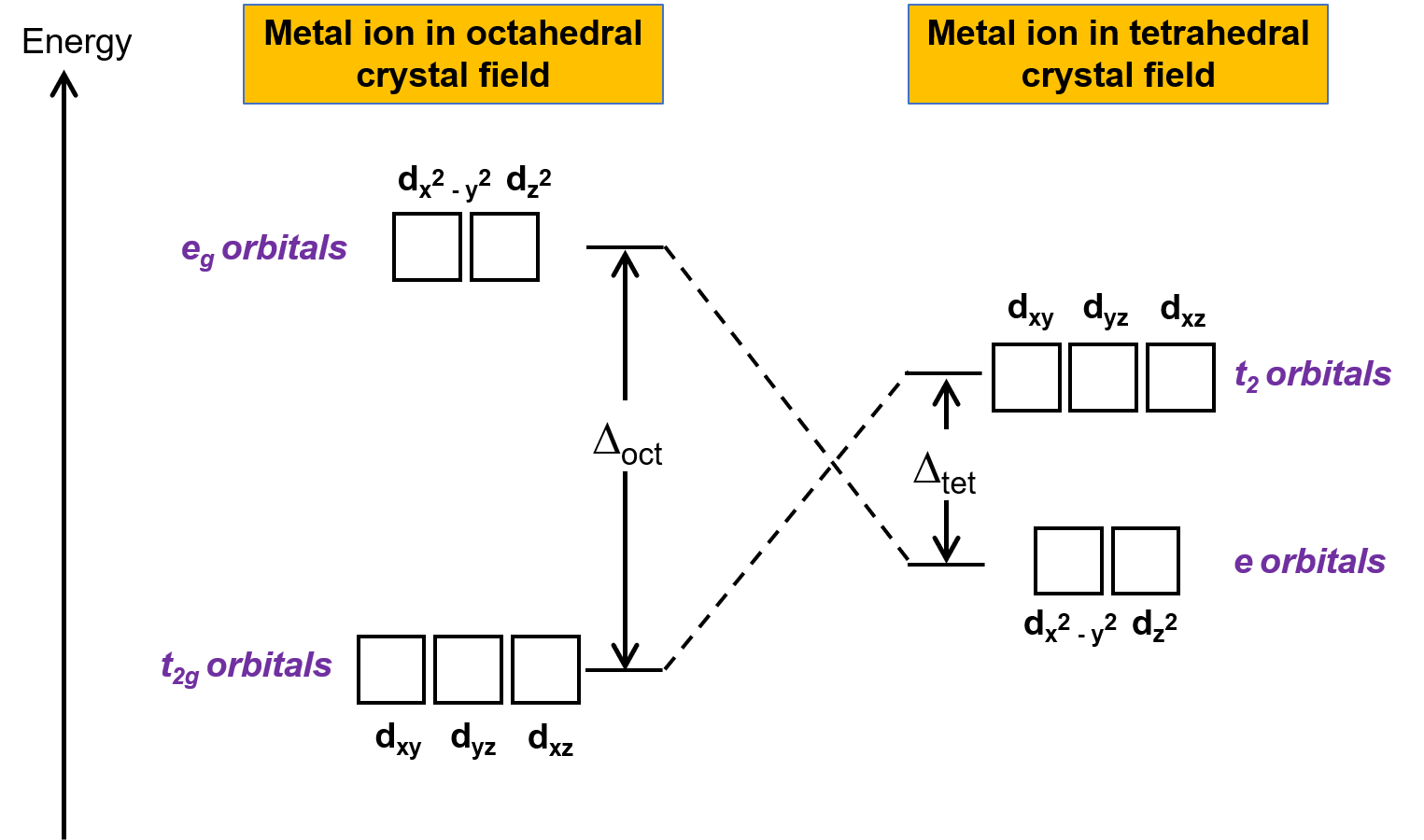
Figure 1.八面体結晶場と四面体結晶場での金属イオンのd軌道の分裂の様子。八面体結晶場と比較して、四面体結晶場での分裂パターンは反転しています。八面体型錯体の結晶場分割エネルギー( Δoct )は、四面体型錯体の結晶場分割エネルギー( Δtet )よりも大きいです。
CFTは静電反発に基づいているため、配位子に近い軌道は不安定になり、他の軌道に比べてエネルギーが上昇します。重なりが少ないので八面体型錯体よりも結晶場分裂は小さく、結晶場の分裂エネルギー、つまり Δtetは通常小さくなります。
平面四角形型錯体
もう1つの一般的な幾何学形状は平面四角形です。正方形の平面構造は、一対のtrans配位子を取り除いた八面体型構造と考えることができます。除去された配位子はz軸上にあると仮定します。これにより、d軌道の分布が変化し、z軸上またはその近くの軌道はより安定化し、xまたはy軸上またはその近くの軌道はより不安定化します。この結果、八面体型におけるt2gとegの縮退が分裂し、より複雑な分裂パターンが得られます。(Figure 2)
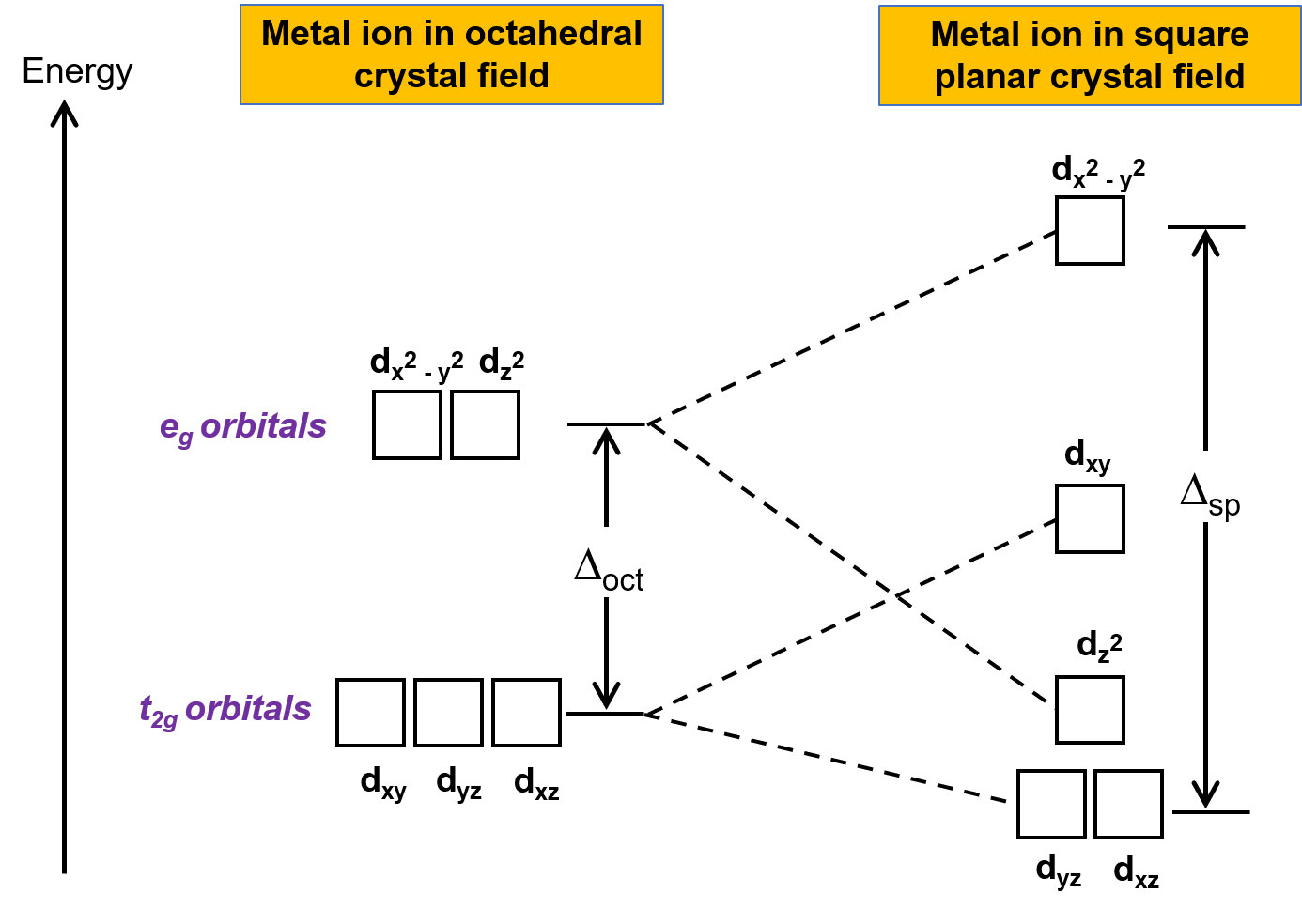
Figure 2. 平面四角形型の結晶場における軌道のt2g軌道とeg軌道の分裂。平面四角形型錯体の結晶場分裂エネルギー( Δsp )は、 Δoct よりも大きいです。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Section 19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
