2.5:
La tavola periodica
2.5:
La tavola periodica
Quando i primi chimici scoprirono più elementi, si resero conto che vari elementi potevano essere raggruppati per i loro simili comportamenti chimici. Uno di questi raggruppamento include litio (Li), sodio (Na) e potassio (K). Tutti questi elementi sono lucenti, conducono bene calore ed elettricità e hanno proprietà chimiche simili. Un secondo raggruppamento comprende calcio (Ca), stronzio (Sr) e bario (Ba), che sono anche lucidi, buoni conduttori di calore ed elettricità, e hanno proprietà chimiche in comune. Tuttavia, le proprietà specifiche di questi due raggruppamenti sono notevolmente diverse l’una dall’altra. Ad esempio, Li, Na e K sono molto più reattivi di Ca, Sr e Ba. Inoltre, Li, Na e K formano composti con ossigeno in un rapporto tra due dei loro atomi e un atomo di ossigeno, mentre Ca, Sr e Ba formano composti con uno dei loro atomi in un atomo di ossigeno. Anche il fluoro (F), il cloro (Cl), il bromo (Br) e lo iodio (I) presentano proprietà simili tra loro, ma queste proprietà sono drasticamente diverse da quelle di uno qualsiasi degli elementi sopra.
Dimitri Mendeleev in Russia (1869) e Lothar Meyer in Germania (1870) riconobbero indipendentemente una relazione periodica tra le proprietà degli elementi conosciuti a quel tempo. Entrambe le tabelle pubblicate con gli elementi disposti in base all’aumento della massa atomica. Tuttavia, Mendeleev andò un passo oltre Meyer; usò il suo tavolo per prevedere l’esistenza di elementi che avrebbero avuto proprietà simili all’alluminio e al silicio ma non erano ancora noti. Le scoperte del gallio (1875) e del germanio (1886) fornivano un supporto significativo al lavoro di Mendeleev. Sebbene Mendeleev e Meyer avessero una lunga disputa sulla priorità, i contributi di Mendeleev allo sviluppo della tavola periodica sono ora più ampiamente riconosciuti.
Nel XX secolo, divenne evidente che la relazione periodica riguardava i numeri atomici piuttosto che le masse atomiche. L’affermazione moderna di questa relazione, la legge periodica, afferma quanto segue: le proprietà deglielementi sono funzioni periodiche dei loro numeri atomici. Una tavola periodica moderna dispone gli elementi in ordine crescente dei loro numeri atomici, e raggruppa atomi con proprietà simili nella stessa colonna verticale. Ogni casella rappresenta un elemento e contiene il suo numero atomico, simbolo, massa atomica media e (a volte) nome.
Gli elementi sono disposti in sette righe orizzontali, chiamate periodi o serie, e 18 colonne verticali, chiamate gruppi. I gruppi sono etichettati nella parte superiore di ogni colonna. Affinché la tabella si adatti a una singola pagina, parti di due righe, per un totale di 14 colonne, vengono solitamente scritte sotto il corpo principale della tabella.
Molti elementi differiscono significativamente nelle loro proprietà chimiche e fisiche, ma alcuni elementi sono simili nei loro comportamenti. Ad esempio, molti elementi appaiono lucidi, sono malleabili e duttili e conducono bene calore ed elettricità. Altri elementi non sono lucidi, malleabili o duttili e sono poveri conduttori di calore ed elettricità. Gli elementi possono essere ordinati in grandi classi con proprietà comuni: metalli (elementi lucidi, malleabili, buoni conduttori di calore ed elettricità – giallo ombreggiato); non metalli (elementi che appaiono opachi, poveri conduttori di calore ed elettricità – rosso ombreggiato); e metalloidi (elementi che conducono moderatamente bene il calore e l’elettricità, e possiedono alcune proprietà dei metalli e alcune proprietà dei non metalli – viola ombreggiato).
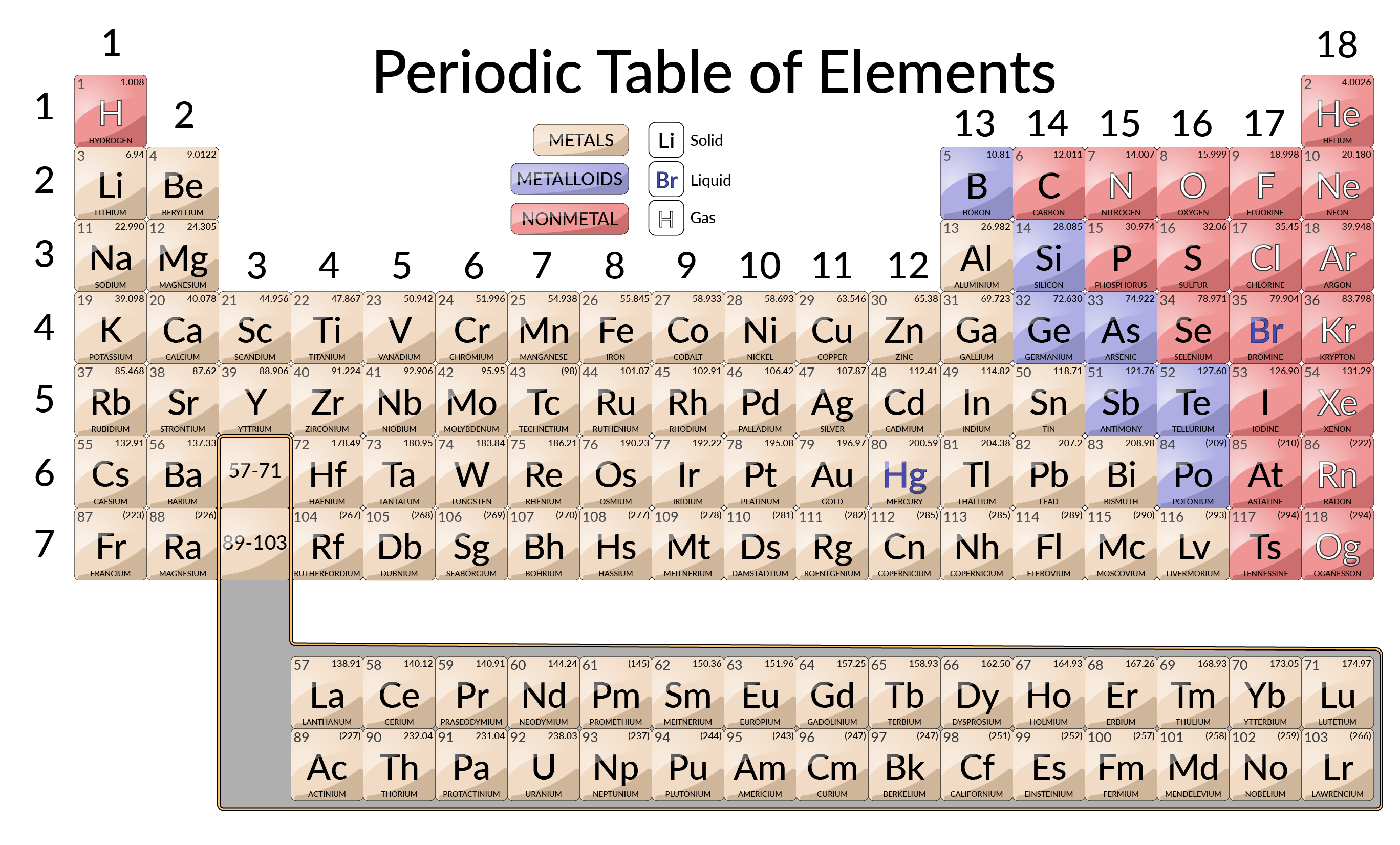
Gli elementi possono anche essere classificati negli elementi del gruppo principale (o elementi rappresentativi) nelle colonne etichettate 1, 2 e 13-18; i metalli di transizione nelle colonne etichettati 3–12; e metalli di transizione interni nelle due file nella parte inferiore del tavolo. Gli elementi della riga superiore nella parte inferiore della tabella sono lantanidi e gli elementi della riga inferiore sono attinidi. Gli elementi possono essere ulteriormente suddivisi per proprietà più specifiche, come la composizione dei composti che formano. Ad esempio, gli elementi del gruppo 1 (la prima colonna) formano composti che consistono in un atomo dell’elemento e un atomo di idrogeno. Questi elementi (eccetto l’idrogeno) sono noti come metalli alcalini, e tutti hanno proprietà chimiche simili. Gli elementi del gruppo 2 (la seconda colonna) formano composti costituiti da un atomo dell’elemento e due atomi di idrogeno: questi sono chiamati metalli alcalini della terra, con proprietà simili tra i membri di quel gruppo.
Altri gruppi con nomi specifici sono i pnictogeni (gruppo 15), i calcogeni (gruppo 16), gli alogeni (gruppo 17) e i gas nobili (gruppo 18, noto anche come gas inerti). I gruppi possono anche essere indicati dal primo elemento del gruppo: Ad esempio, i calcogeni possono essere chiamati gruppo ossigeno o famiglia di ossigeno. L’idrogeno è un elemento unico e non metallico con proprietà simili agli elementi del gruppo 1 e del gruppo 17. Per questo motivo, l’idrogeno può essere mostrato nella parte superiore di entrambi i gruppi, o da solo.
L’elemento 43 (tecnezio), l’elemento 61 (promezio), e la maggior parte degli elementi con numero atomico 84 (polonio) e superiore hanno la loro massa atomica data tra parentesi quadre. Questo viene fatto per elementi che consistono interamente in isotopi radioattivi instabili (la radioattività è coperta in modo più dettagliato nel capitolo sulla chimica nucleare). Un peso atomico medio non può essere determinato per questi elementi perché i loro radioisotopi possono variare significativamente in abbondanza relativa, a seconda della fonte, o potrebbero anche non esistere in natura. Il numero tra parentesi quadre è il numero di massa atomica, che è una massa atomica approssimativa dell’isotopo più stabile di quell’elemento.
Testo adattato da Openstax, Chimica 2e, Sezione 2.5: La Tavola Periodica.
