7.14:
Il principio di Aufbau e la regola di Hund
7.14:
Il principio di Aufbau e la regola di Hund
Per determinare la configurazione elettronica per ogni particolare atomo, possiamo costruire le strutture nell’ordine dei numeri atomici. Iniziando con l’idrogeno, e continuando attraverso i periodi della tavola periodica, aggiungiamo un protone alla volta al nucleo e un elettrone al sottoguscio corretto fino a quando non abbiamo descritto le configurazioni degli elettroni di tutti gli elementi. Questa procedura è chiamata principio aufbau, dalla parola tedesca aufbau (“costruire”). Ogni elettrone aggiunto occupa il sottoguscio di energia più bassa disponibile, fatte salve le limitazioni imposte dai numeri quantici consentiti secondo il principio di esclusione di Pauli. Gli elettroni entrano in sottoshell ad alta energia solo dopo che i sottoshell a bassa energia sono stati riempiti in capacità. La figura 1 illustra il modo tradizionale di ricordare l’ordine di riempimento per gli orbitali atomici.
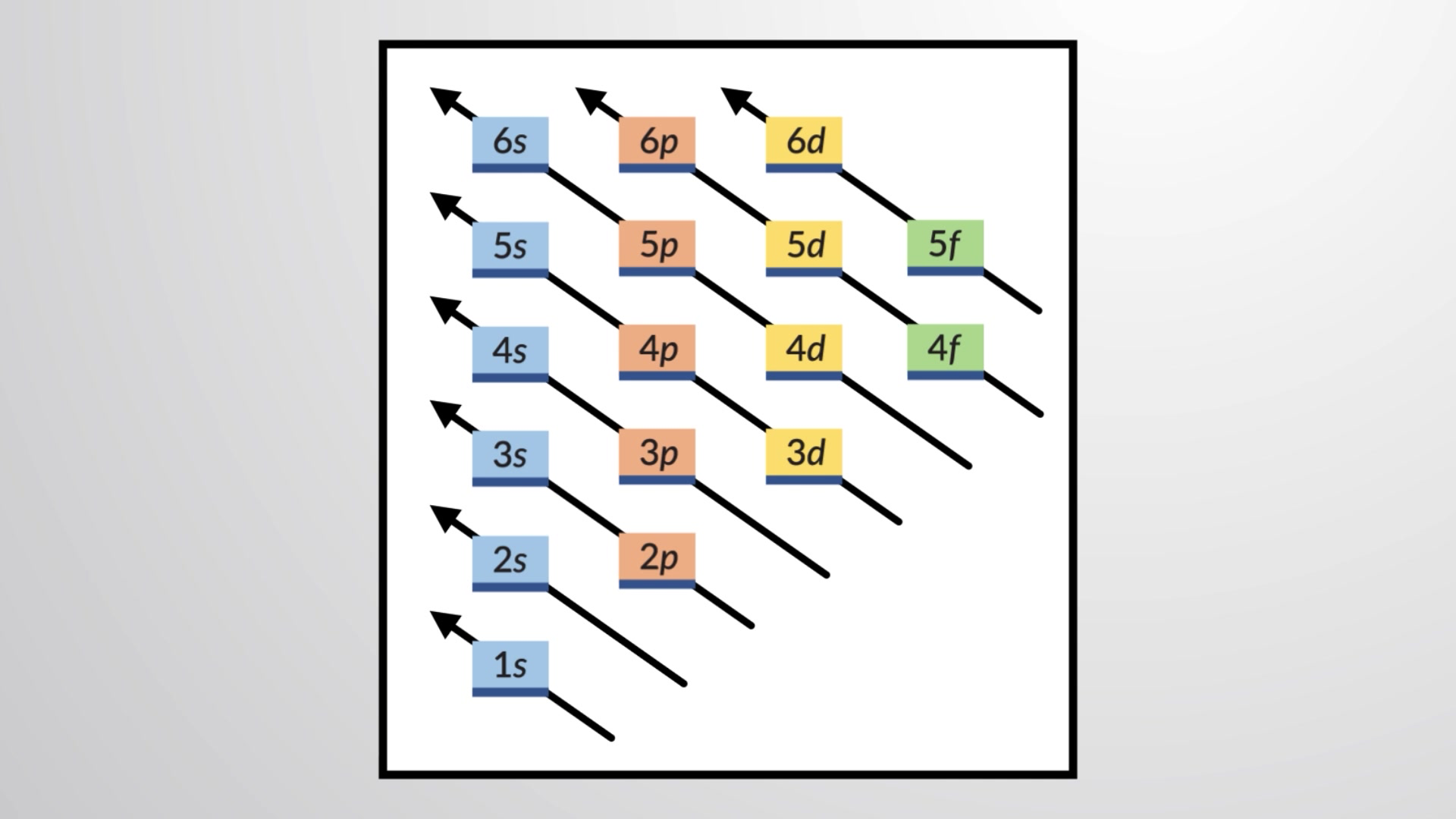
Figura 1 Questo diagramma descrive l’ordine energetico per gli orbitali atomici ed è utile per derivare configurazioni di elettroni allo stato del suolo.
Prendere in considerazione la possibilità di scrivere la configurazione elettronica per il carbonio, un elemento con numero atomico sei. Quattro elettroni riempiono gliorbitali 1s e 2 s. Gli altri due elettroni occupano il sottoguscio di 2p. Ora abbiamo la possibilità di riempire uno degli orbitali a 2p e accoppiare gli elettroni o di lasciare gli elettroni spaiati in due orbitali p diversi, ma degenerati. Gli orbitali sono riempiti come descritto dalla regola di Hund: la configurazione a più bassa energia per un atomo con elettroni all’interno di un insieme di orbitali degenerati è quella con il numero massimo di elettroni spaiati. Così, i due elettroni negli orbitali di carbonio 2p hanno numeri quantici n, le ms identici e differiscono nel loro numero quantico ml (in accordo con il principio di esclusione di Pauli). Il diagramma orbitale per il carbonio, con una configurazione elettronica di 1s22s21p2 è:

L’azoto (numero atomico 7) riempie le sottoshell 1s e 2s e ha un elettrone in ciascuno dei tre orbitali da 2p, secondo la regola di Hund. Questi tre elettroni hanno spin spaiati. L’ossigeno (numero atomico 8) ha una coppia di elettroni in uno qualsiasi degli orbitali 2p (gli elettroni hanno spin opposti) e un singolo elettrone in ciascuno degli altri due. Il fluoro (numero atomico 9) ha un solo orbitale da 2p contenente un elettrone spaiato. Tutti gli elettroni nel neon a gas nobile (numero atomico 10) sono accoppiati, e tutti gli orbitali nei gusci n = 1 e n = 2 sono riempiti.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 6.4: Struttura elettronica degli atomi.
