10.1:
Teoria da VSEPR e as Formas Básicas
10.1:
Teoria da VSEPR e as Formas Básicas
Visão Geral da Teoria da VSEPR
A teoria da repulsão dos pares de eletrões da camada de valência (teoria da VSEPR) permite-nos prever a estrutura molecular, incluindo ângulos de ligação aproximados em torno de um átomo central, de uma molécula a partir da examinação do número de ligações e pares de eletrões solitários na sua estrutura de Lewis. O modelo da VSEPR assume que pares de eletrões da camada de valência de um átomo central irão adoptar um arranjo que minimize as repulsões entre esses pares de eletrões, maximizando a distância entre eles. Os eletrões da camada de valência de um átomo central formam pares de eletrões, localizados principalmente entre átomos ligados, ou pares solitários. A repulsão eletrostática desses eletrões é reduzida quando as várias regiões de alta densidade de eletrões assumem posições o mais afastadas possível.
A teoria da VSEPR prevê o arranjo de pares de eletrões ao redor de cada átomo central e, geralmente, o arranjo certo de átomos em uma molécula. Devemos entender, no entanto, que a teoria considera apenas repulsões de pares de eletrões. Outras interações, como repulsões núcleo-núcleo e atrações núcelo-eletrão, também estão envolvidas no arranjo final que os átomos adoptam em uma estrutura molecular específica.
Aplicação da Teoria da VSEPR
A teoria da VSEPR pode ser usada para prever a estrutura das moléculas. Por exemplo, vamos prever a estrutura de uma molécula de CO2 gasoso. A estrutura de Lewis de CO2 (Figura 1) mostra apenas dois grupos de eletrões ao redor do átomo de carbono central. Com dois grupos de ligação e sem pares solitários de eletrões no átomo central, as ligações estão o mais afastadas possível, e a repulsão eletrostática entre estas regiões de alta densidade de eletrões é reduzida ao mínimo quando estão em lados opostos do átomo central. O ângulo de ligação é de 180°.
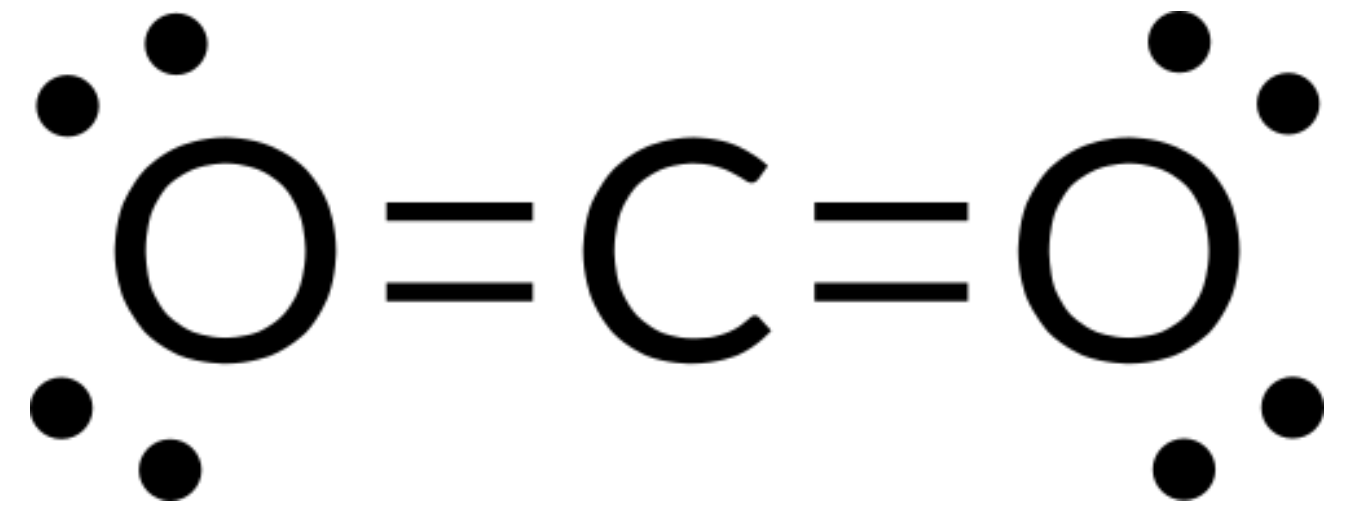
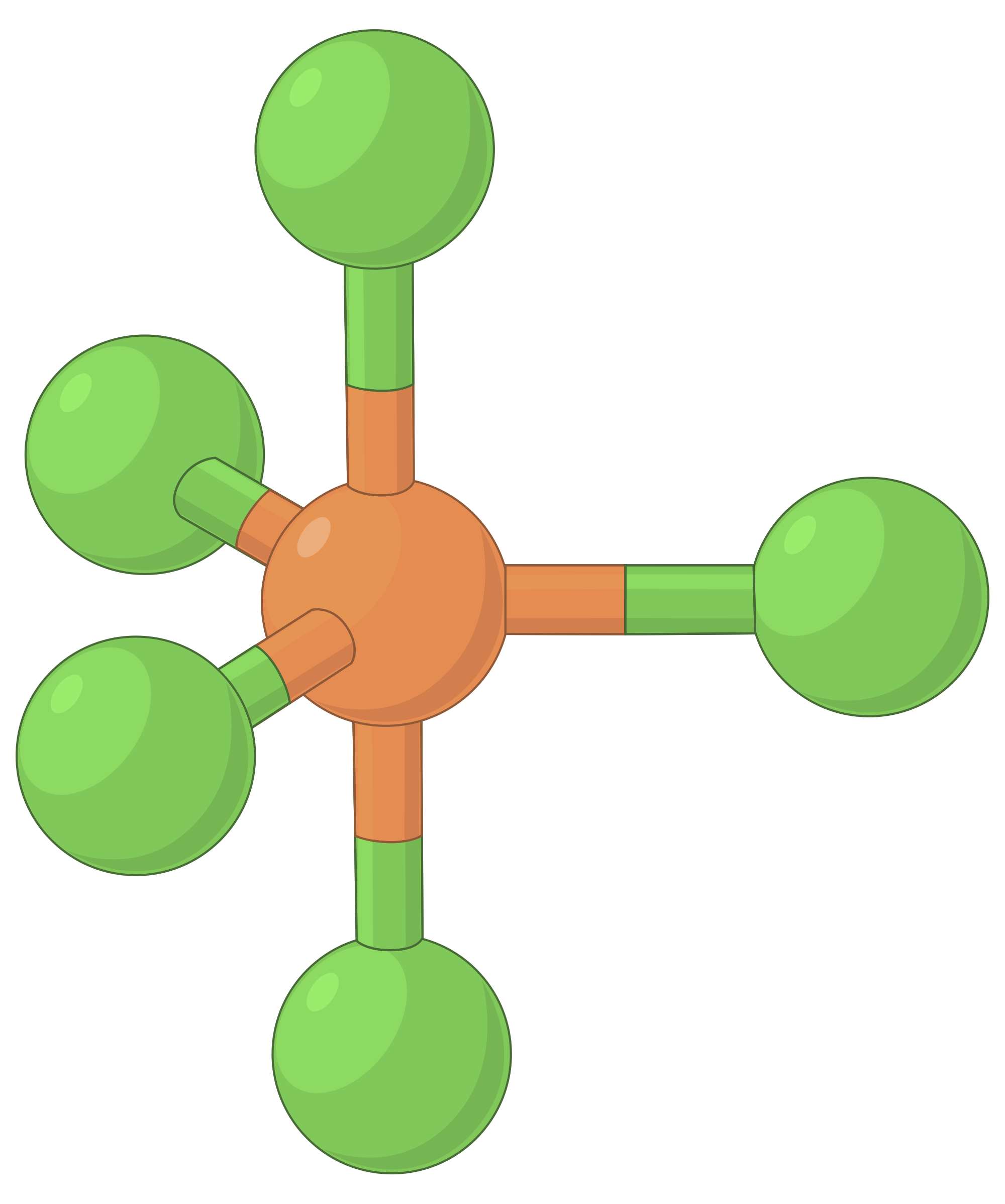
A tabela abaixo ilustra geometrias de pares de eletrões que minimizam as repulsões entre regiões de alta densidade de eletrões (ligações e/ou pares solitários). Duas regiões de densidade de eletrões ao redor de um átomo central em uma molécula formam uma geometria linear; três regiões formam uma geometria trigonal plana; quatro regiões formam uma geometria tetraédrica; cinco regiões formam uma geometria trigonal bipiramidal e seis regiões formam uma geometria octaédrica.
| BeF2 | BF3 | CH4 | PCl5 | SF6 | |
| Número de regiões de eletrões | 2 | 3 | 4 | 5 | 6 |
| Geometria de região de eletrões | Linear; ângulo de 180° | Trigonal plana; todos os ângulos de 120° | Tetraédrica; todos os ângulos de 109,5° | Trigonal bipiramidal, ângulos de 90° ou 120°. | Octaédrica; todos os ângulos de 90° ou 180°. |
| Arranjo espacial | 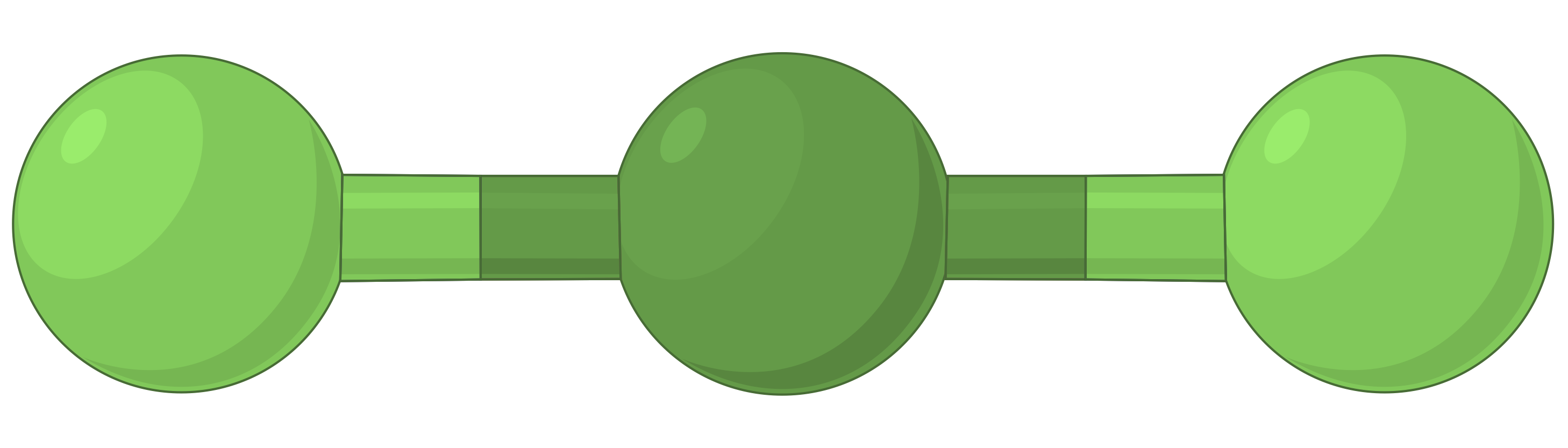 |
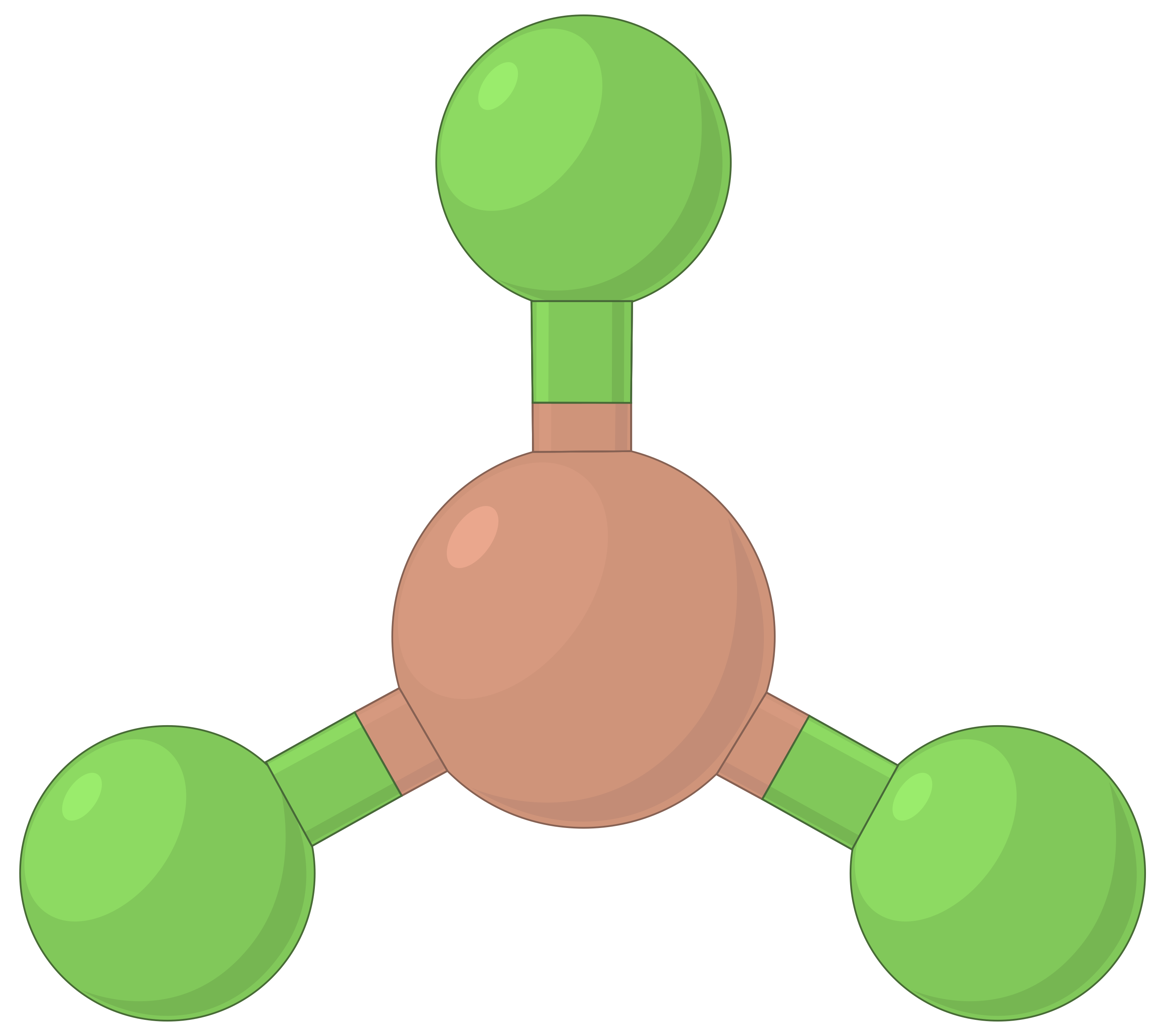 |
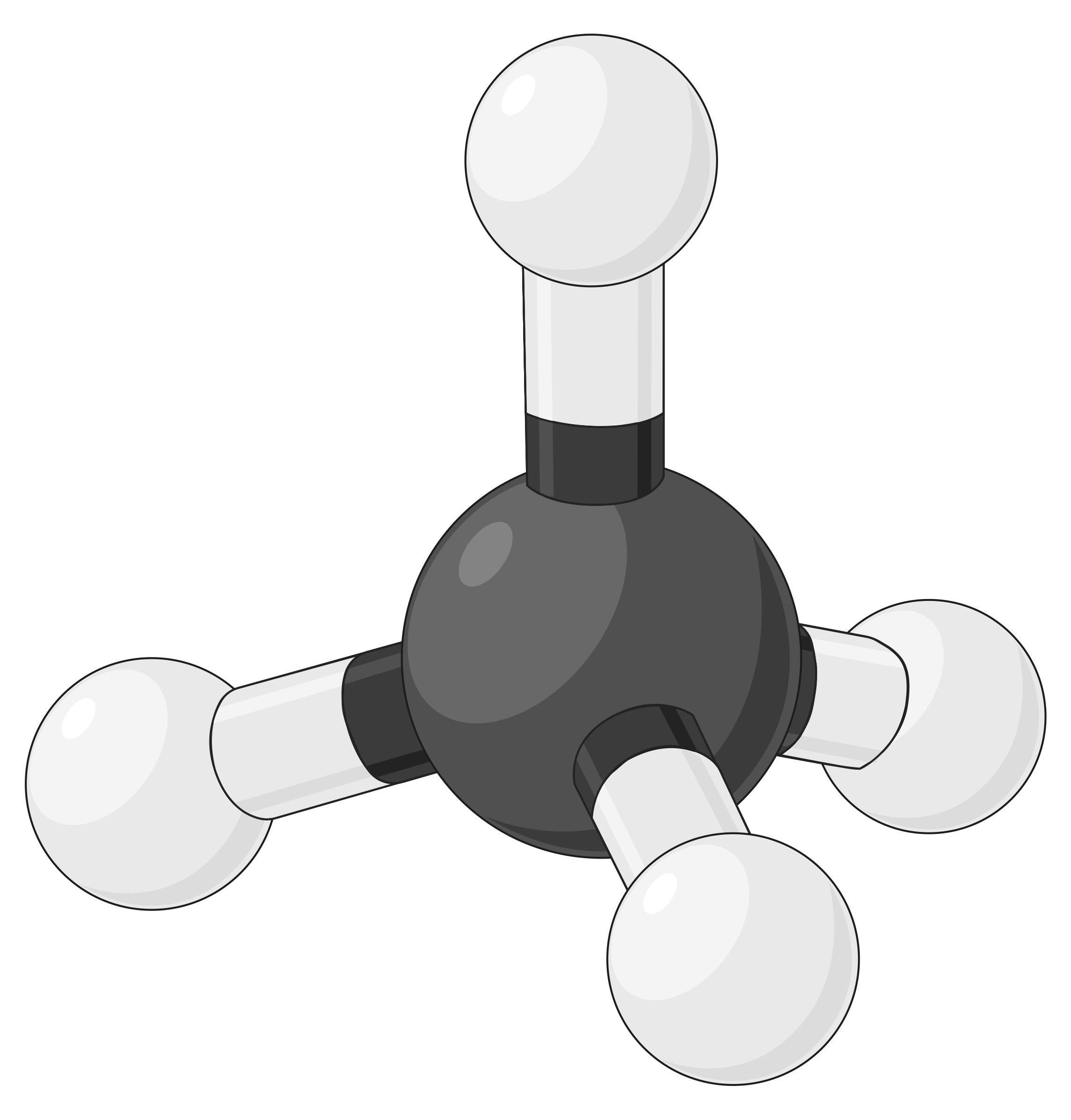 |
 |
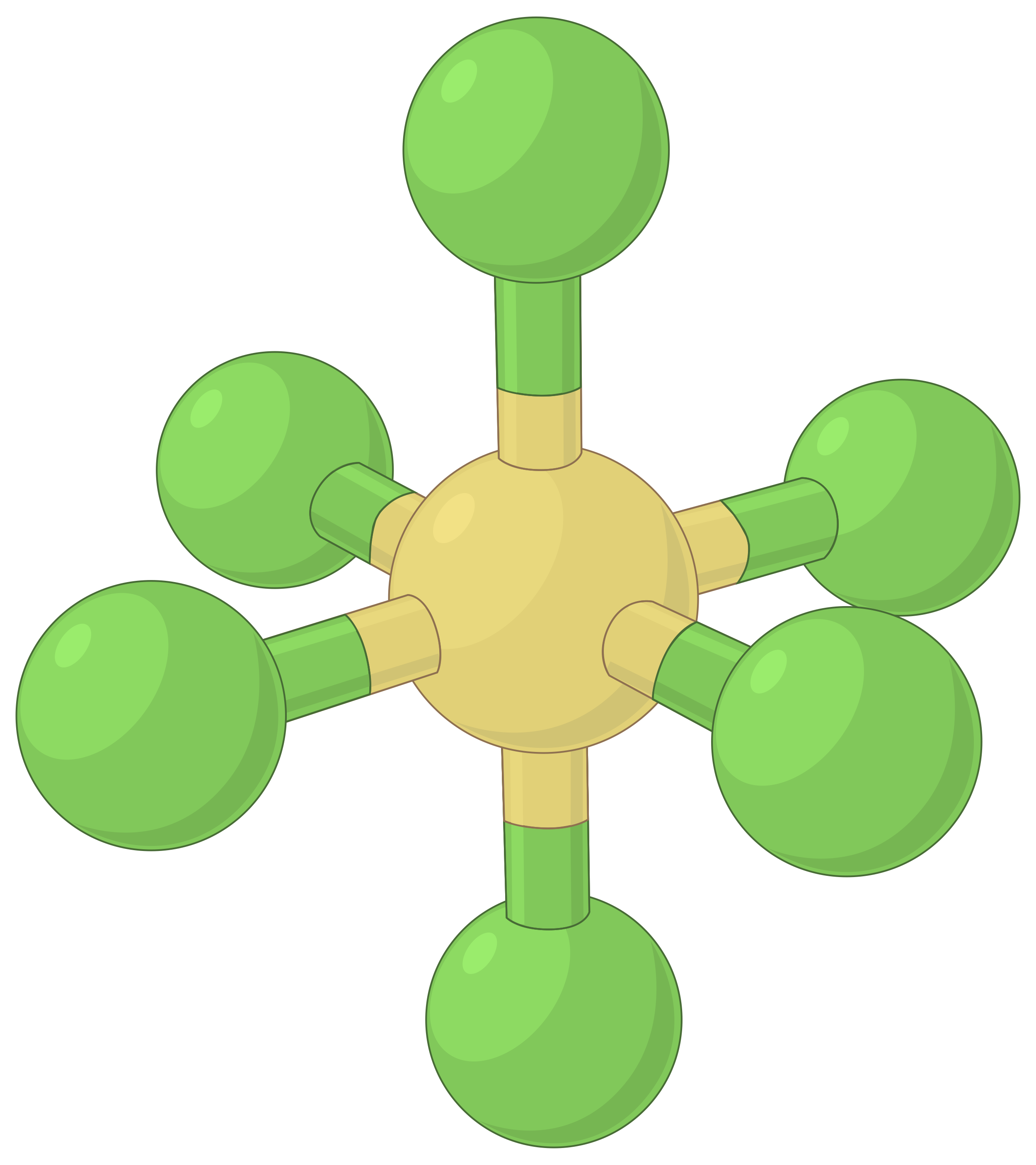 |
Tabela 1. As geometrias básicas de pares de eletrões previstas pela teoria da VSEPR maximizam o espaço em torno de qualquer região de densidade de eletrões (ligações ou pares solitários).
Este texto foi adaptado de Openstax, Chemistry 2e, Section 7.6: Molecular Structure and Polarity.
