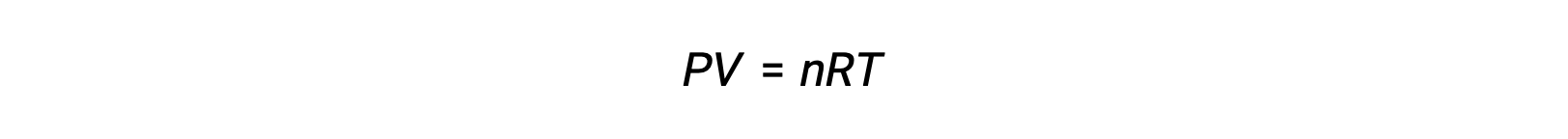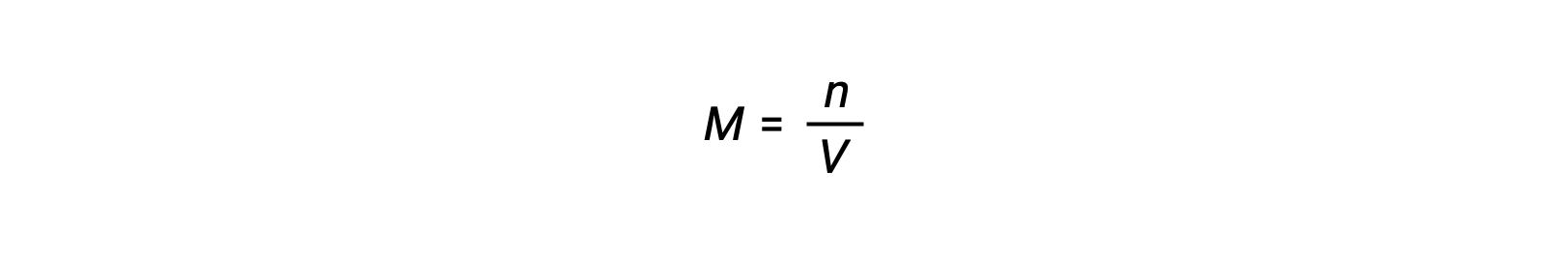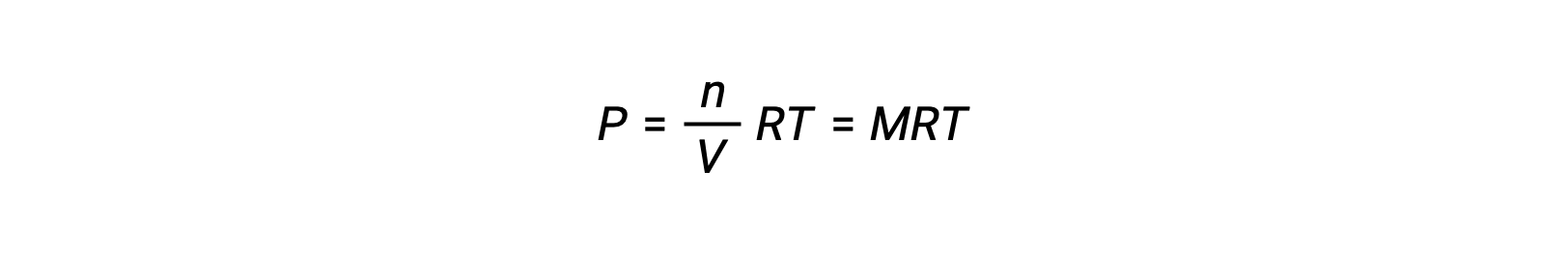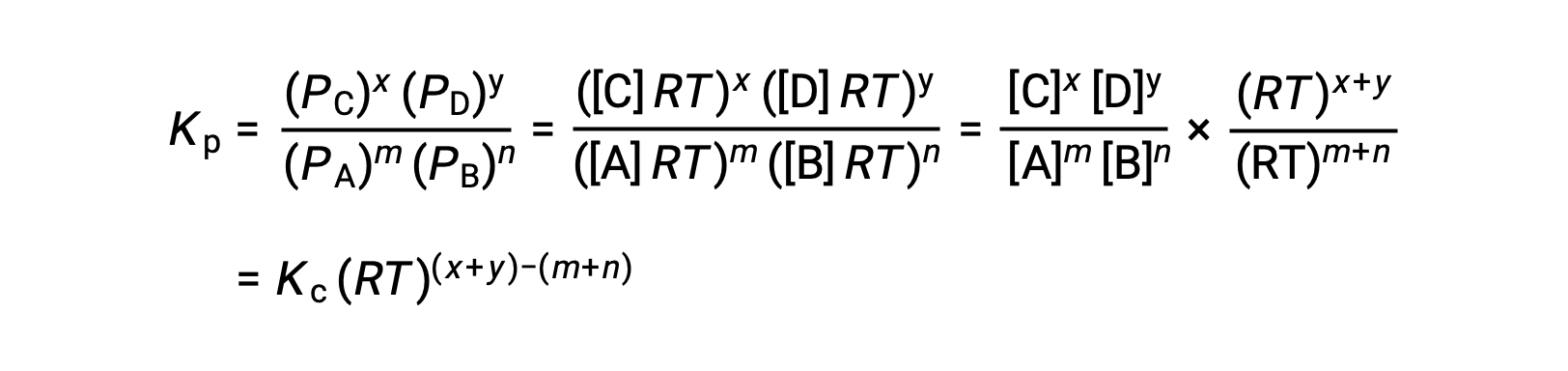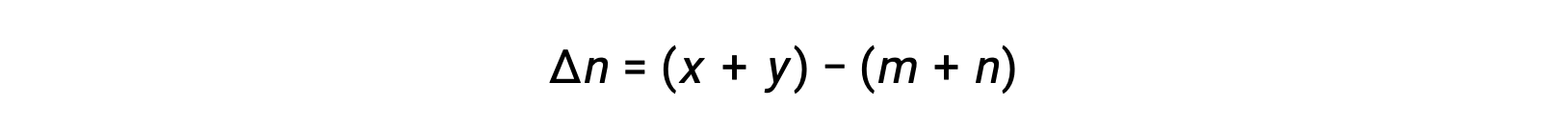Per le reazioni chimiche, in cui i reagenti e i prodotti sono tutti gas, la costante di equilibrio può essere calcolata anche utilizzando le singole pressioni parziali anziché le loro concentrazioni molari. Pertanto, quando i gas A e B si convertono in gas C e D in una reazione reversibile, l’espressione di equilibrio può essere, invece, scritta come la pressione parziale di ciascun gas, elevata ai loro coefficienti stechiometrici. La costante di equilibrio è designata come Kp, dove il pedice p indica la pressione.Per una data reazione gassosa, Kp non è necessariamente uguale a Kc, perché la pressione parziale di un gas e la sua concentrazione molare sono valori separati. Tuttavia, è possibile derivare una relazione fra le due costanti utilizzando l’equazione del gas ideale e la definizione di molarità. Per derivare questa relazione, occorre considerare le espressioni di equilibrio per Kc e Kp per la data reazione chimica.L’equazione dei gas ideali mette in relazione la pressione di un gas con il suo numero di moli e il suo volume, ad una data temperatura. La sostituzione del rapporto fra moli e volume per molarità nell’equazione dei gas ideali consente di esprimere la pressione di un gas ideale in termini di concentrazione molare. In questo modo, le singole pressioni parziali nell’espressione per Kp possono essere sostituite dalla concentrazione equivalente di ciascun gas.I coefficienti stechiometrici rimangono invariati. Nell’espressione modificata di Kp, il rapporto fra la concentrazione dei prodotti e la concentrazione dei reagenti può essere sostituito con Kc.Questa equazione fornisce la relazione fra le due costanti Kp è uguale a Kc per RT elevato alla somma dei coefficienti dei prodotti meno la somma dei coefficienti dei reagenti. La differenza fra i coefficienti dei reagenti gassosi e dei prodotti può essere rappresentata come delta n.n, la costante di equilibrio viene aumentata allo stesso fattore. La nuova costante di equilibrio sarebbe ora x elevata alla potenza di n. Quando due o più reazioni individuali vengono sommate, la costante di equilibrio per la reazione complessiva è il prodotto delle singole costanti di equilibrio.Quindi, la nuova costante di equilibrio sarebbe y moltiplicata z. Per un equilibrio eterogeneo, l’espressione della costante di equilibrio esclude entità puramente solide o liquide. Per esempio, l’espressione della costante di equilibrio per la decomposizione del nitrato di ammonio solido in protossido di azoto gassoso e vapore acqueo, esclude il nitrato di ammonio un solido puro.Questo perché la concentrazione molare relativa di un solido o liquido puro rimane costante durante la reazione.