15.5:
Относительные силы конъюгированных кислотно-основных пар
15.5:
Относительные силы конъюгированных кислотно-основных пар
Химия Брёнстед-Лоури кислотно-основная является передачей протонов; таким образом, логика предполагает взаимосвязь между относительными сильными сторонами сопряженных пар кислотно-основная. Сила кислоты или основание определяется в его константе ионизации Ka или Kb, которая представляет степень реакции ионизации кислоты или основание. Для сопряженной пары кислотно-основная HA/A– уравнения ионизационного равновесия и выражения констант ионизации являются
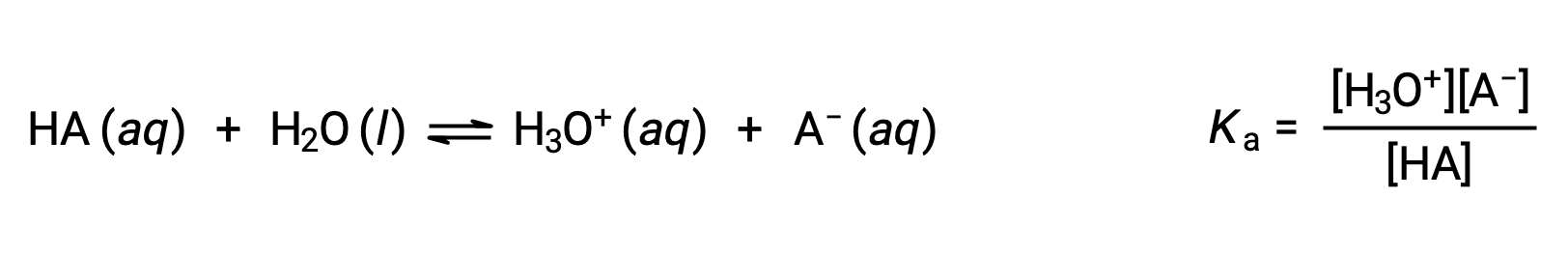
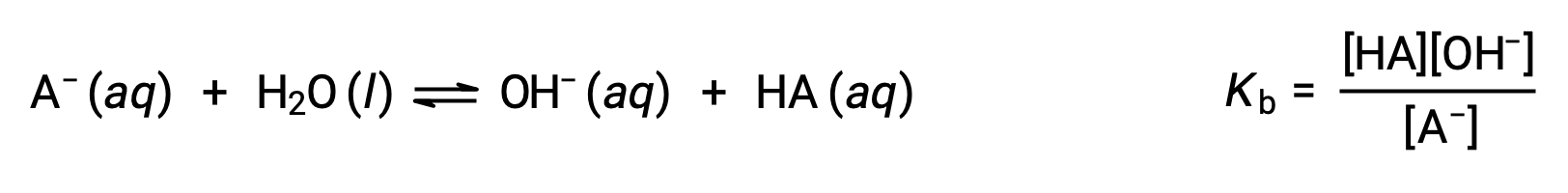
Добавление этих двух химических уравнений приводит к уравнению для автоматической ионизации воды:
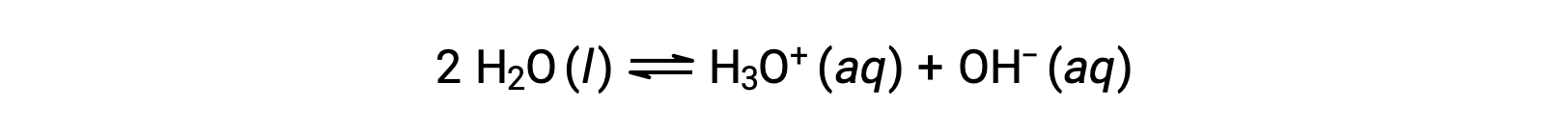
Как уже говорилось ранее, константа равновесия для суммированной реакции равна математическому произведению констант равновесия для добавленных реакций, и так далее
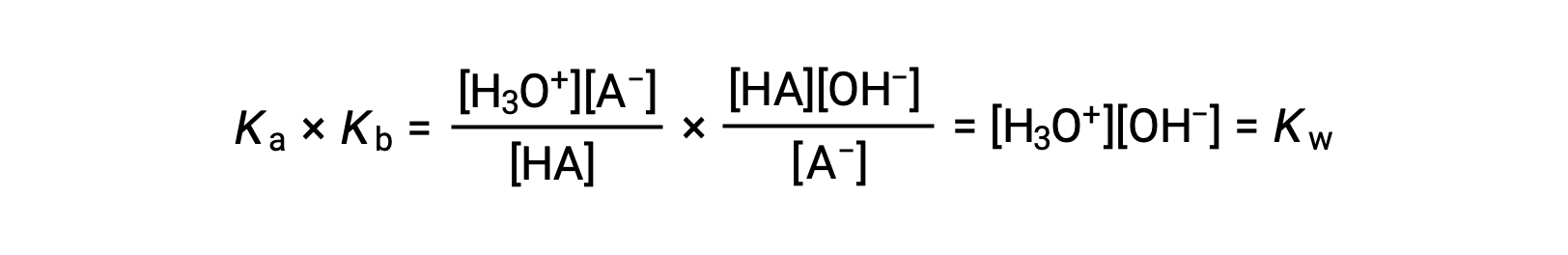
В этом уравнении определяется соотношение между константами ионизации для любой сопряженной пары кислотно-основная, а именно, их математический продукт равен ионному продукту воды, КВТ. При перестановке этого уравнения становится очевидной обратная связь между сильными сторонами сопряженной пары кислотно-основная:
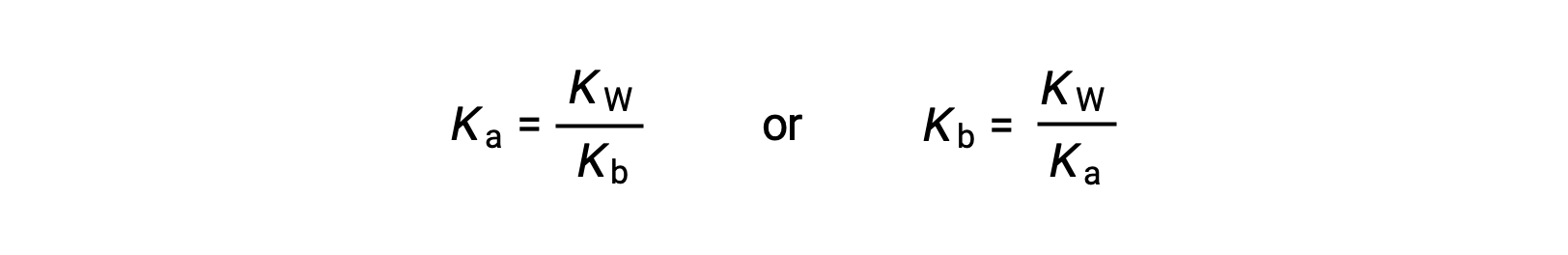
Обратное пропорциональное соотношение между Ка и Кбайт означает, что чем сильнее кислота или основание, тем слабее ее ее партнер-конъюгат.
Принимая негативный логарифмик обеих сторон уравнения, Ка × Кбайт = МОЩНОСТЬ КВТ
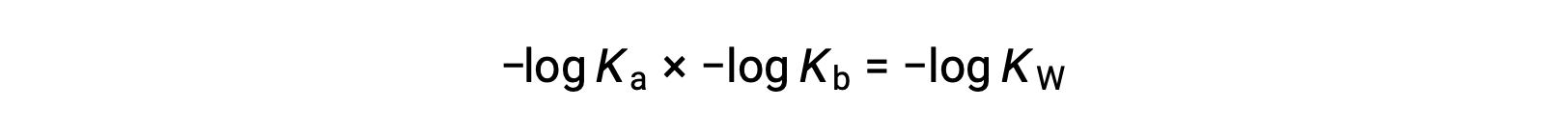
затем
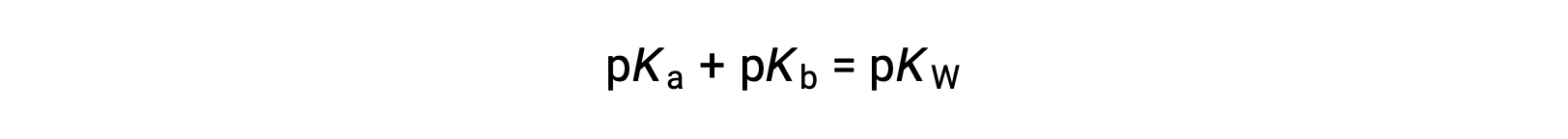
Поскольку PKW составляет 14 при 25 °C, это уравнение также можно записать как
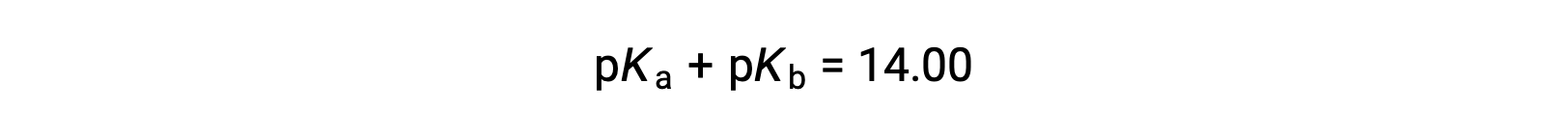
PKa и PKB также представляют силу кислот и оснований, соответственно. Как и pH и Poh, чем выше значение pKa или PKB, тем слабее кислота или основание, соответственно.
| Кислота | основание |
| Перхлоральная кислота (HClO4)* | Перхлорат-ион (ClO4–)** |
| Серная кислота (H2SO4)* | Ион сульфата водорода (HSO4–)** |
| Йодид водорода (HI)* | Иодид ион (I–)** |
| Бромистый водород (HBR)* | Бромистый ион (br–)** |
| Хлорид водорода (HCl)* | Ион хлорида (CL–)** |
| Азотная кислота (HNО3)* | Ион нитрата (NО3–)** |
| Гидроний ион (H3O+) | Вода (H2O) |
| Ион сульфата водорода (HSO4–) | Сульфат-ион (SO42–) |
| Фосфорная кислота (H3PO4) | Ион диводоросфата (H2PO4–) |
| Фторид водорода (HF) | Ион фторида (F–) |
| Закись азота (HNО2) | Нитритный ион (NО2–) |
| Уксусная кислота (CH3CO2H) | Ацетатный ион (CH3CO2–) |
| Углекислая кислота (H2CO3) | Карбонатный ион водорода (HCO3–) |
| Сероводород (H2S) | Ион сероводорода (HS–) |
| Ион аммония (NH4+) | Аммиак (NH3) |
| Цианид водорода (HCN) | Ион цианида (CN–) |
| Карбонатный ион водорода (HCO3–) | Карбонатный ион (CO32–) |
| Вода (H2O) | Гидроксид ион (OH–) |
| Ион сероводорода (HS–)† | Сульфидный ион (S2–)‡ |
| Этанол (C2H5OH)† | ‡ |
| Аммиак (NH3)† | Амид ион (NH2–)‡ |
| Водород (H2)† | Гидрид ион (H-)‡ |
| Метан (CH4)† | Ион метила (CH3–)‡ |
| * пройти полную кислотную ионизацию в воде | |
| † не подвергается кислотной ионизации в воде | |
| **не проходит ионизацию основание в воде | |
| ‡ проходят полную ионизацию основание в воде | |
Показано, что в списке сопряженных кислотно-базовых пар показано относительное значение силы каждого вида по сравнению с водой. В кислотной колонке перечисленные ниже виды являются более слабыми кислотами, чем вода. Эти виды не подвергаются кислотной ионизации в воде; они не являются Брёнстед-Лоури кислотами. Все перечисленные выше виды воды являются более сильными кислотами, передавая протоны в воду в некоторой степени при растворении в водном растворе раствор для получения ионов гидрония. Виды, расположенные над водой, но ниже иона гидрония, являются слабыми кислотами, которые проходят частичную кислотную ионизацию, в то время как виды, расположенные над ионом гидрония, являются сильными кислотами, полностью ионизированными в водном растворе раствор.
Этот текст адаптирован из Openstax, Chemistry 2e, раздел 14.3: Относительные силы кислот и оснований.
