16.6:
滴定計算:強酸-強塩基
Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
JoVE Core
Chimie
Titration Calculations: Strong Acid – Strong Base
When a strong acid is titrated with a strong base or vice versa, the pH throughout the titration can be calculated by determining the concentration of the remaining hydronium or hydroxide ions. For example, 50 mL of 0.10 M hydrochloric acid dissociates into 0.10 M hydronium and chloride ions with an initial pH of one. If 25 mL of 0.10 M sodium hydroxide is added, the new concentration of hydronium ions can be calculated by subtracting the total moles of hydroxide ions from the total moles of hydronium ions and dividing it by the total volume—75 mL or 0.075 L. 50 mL of 0.10 M hydrochloric acid contains 0.0050 moles of hydronium, while 25 mL of 0.10 M sodium hydroxide has 0.0025 moles of hydroxide ions. Substituting these values into the equation, the hydronium ion concentration equals 0.033 M. Therefore, the pH of the solution has risen to 1.48. If the addition of sodium hydroxide is continued up to 50 mL, all the hydronium ions from hydrochloric acid get neutralized, and the equivalence point is reached when the pH rises to seven. Above the equivalence point, the pH of the solution is determined by the hydroxide ions, as the hydrochloric acid has been completely neutralized. If 70 mL of sodium hydroxide solution containing 0.0070 moles of hydroxide ions is added into the solution, the final concentration of hydroxide ions can be determined by subtracting the initial moles of hydronium ions from the total moles of hydroxide ions and dividing it by the total volume of the solution. As the final hydroxide ion concentration is 0.017 M, the pOH and pH of the solution equal 1.78 and 12.22, respectively.
16.6:
滴定計算:強酸-強塩基
滴定溶液のpH計算: 強酸および強塩基
0.100 MのHCl(強酸)25.00 mLを0.100 MのNaOH(強塩基)で滴定する場合を考えます。加えた塩基性溶液の量が異なるときのpHは、以下のように計算できます。
(a) 滴定液の容量=0 mLの場合。この溶液のpHは、HClの電離により決定されます。HClは強酸なので全て電離し、ヒドロニウムイオンのモル数は0.100 Mとなります。溶液のpHは、

(b) 滴定液量 = 12.50 mLの場合。酸および塩基はともに1価かつ等濃度であるため、この滴定溶液の添加に伴う塩基の量は化学量論的な量よりも少なく、溶液中の過剰な酸との反応で完全に消費されます。残った酸の濃度は、最初の量から消費された量を差し引き、溶液の体積で割って算出します。
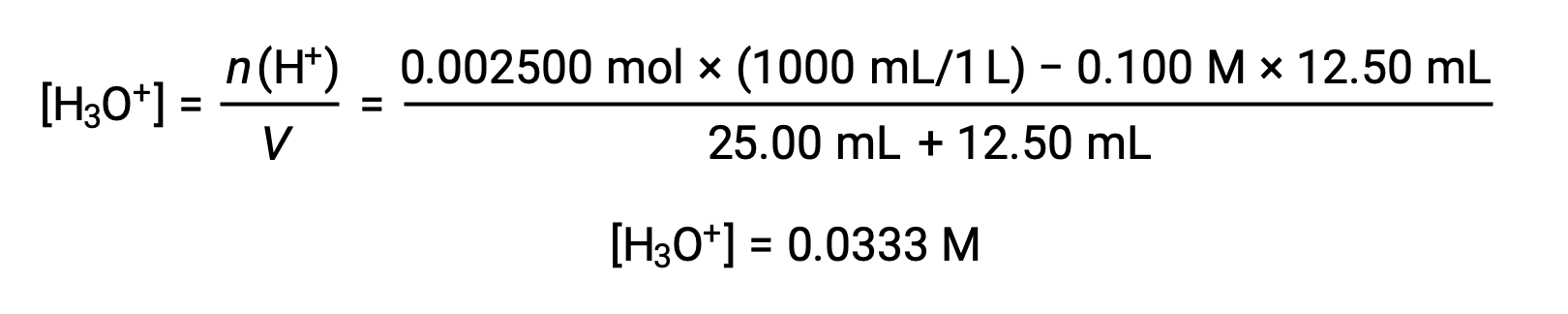
(c) 滴定液量 = 25.00 mLの場合。この量の滴定溶液には化学量論的な塩基量が含まれているため(等量点)、中和反応の生成物のみが溶液中に存在します(水とNaCl)。この塩の陽イオンも陰イオンも加水分解を起こさず、ヒドロニウムイオンを生成する唯一のプロセスは水の電離です。溶液は中性で、pH=7.00です。
(d) 滴定液量 = 37.50 mLの場合。これは、滴定溶液が当量点を超えて添加されていることを意味します。溶液のpHは水酸化物イオンの濃度から算出できます。
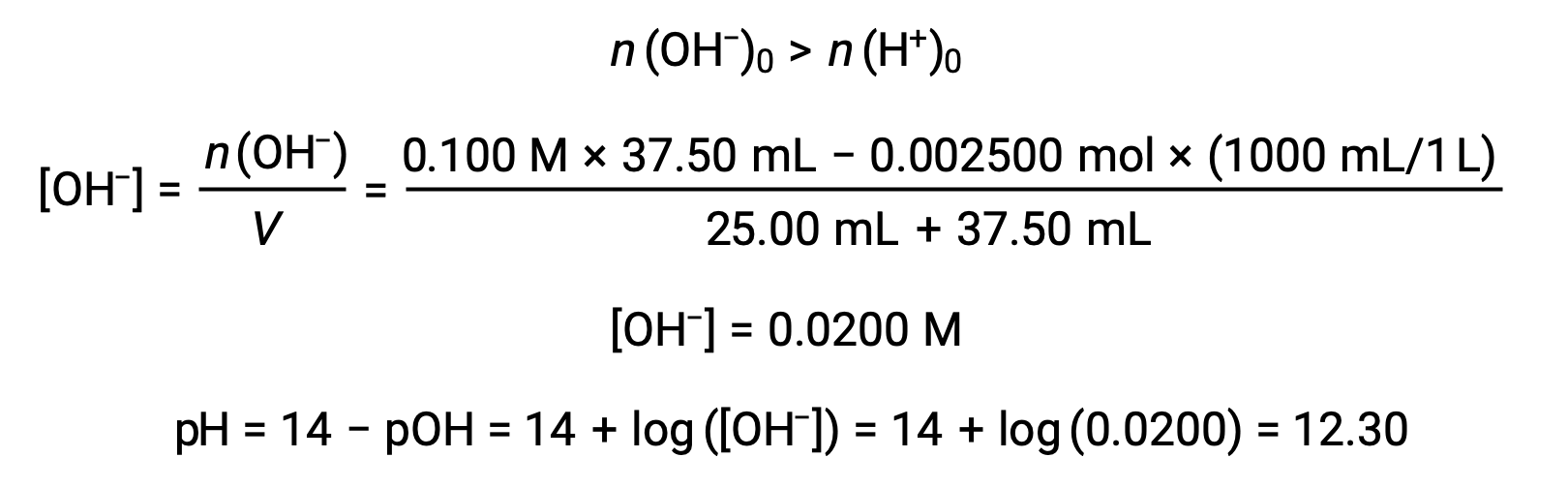
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
