16.7:
적정 계산: 약산 - 약염기
16.7:
적정 계산: 약산 - 약염기
적정 용 용 pH 계산 : 약한 산 /강한 염기
0.100 M NAOH와 0.100 M CH3CO2H의 25.00 mL의 적정에 대 한, 반응으로 표현 될 수 있다:
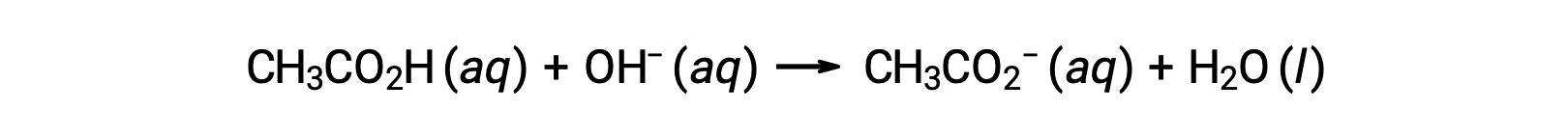
NaOH 적판의 상이한 부피의 첨가 후 적정 용액의 pH는 다음과 같이 계산될 수 있다.
(a) 초기 pH는 일반적인 ICE 접근법에서 아세트산 용액을 위해 계산됩니다.
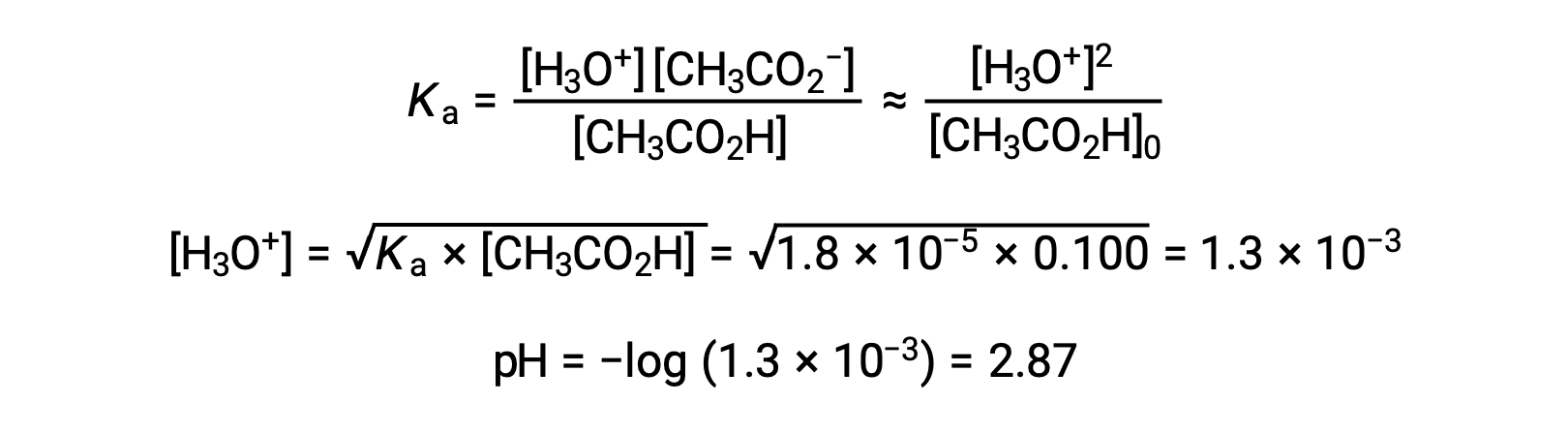
(b) 산및 적정은 단보틱성이며 시료 및 적정성 솔루션은 동등하게 농축된다; 따라서, 이 적음부들은 동등점을 나타낸다. 강한 산 예와는 달리, 이 경우 반응 혼합물은 약한 컨쥬게이트 염기(acetate ion)를 함유하고 있다. 솔루션 pH는 아세테이트의 기본 이온화를 고려하여 계산되며, 이는
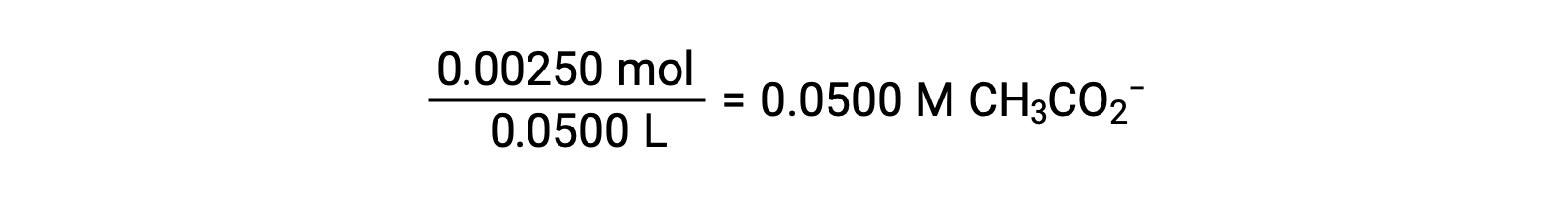
아세테이트의 기본 이온화는 방정식으로 표현됩니다.
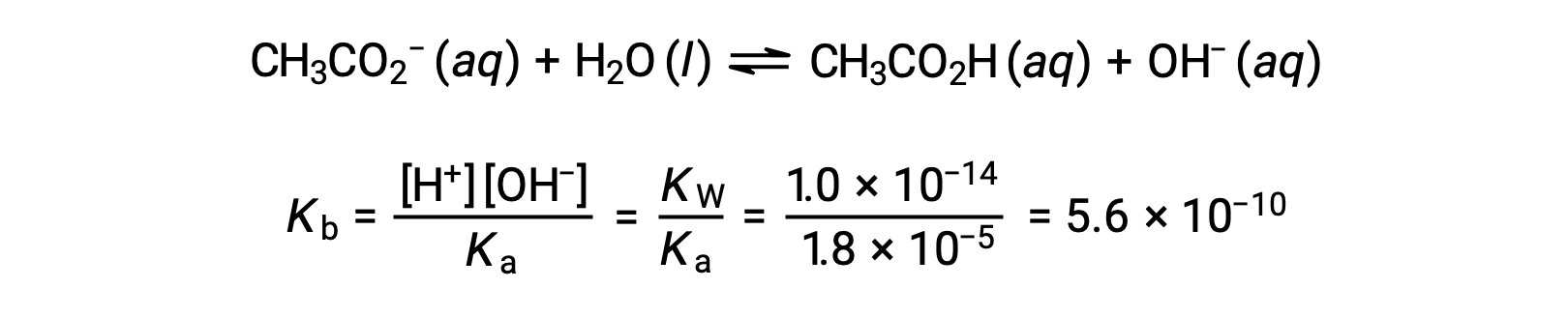
x< 0.0500을 가정하면 pH는 일반적인 ICE 접근 방식을 통해 계산될 수 있습니다.
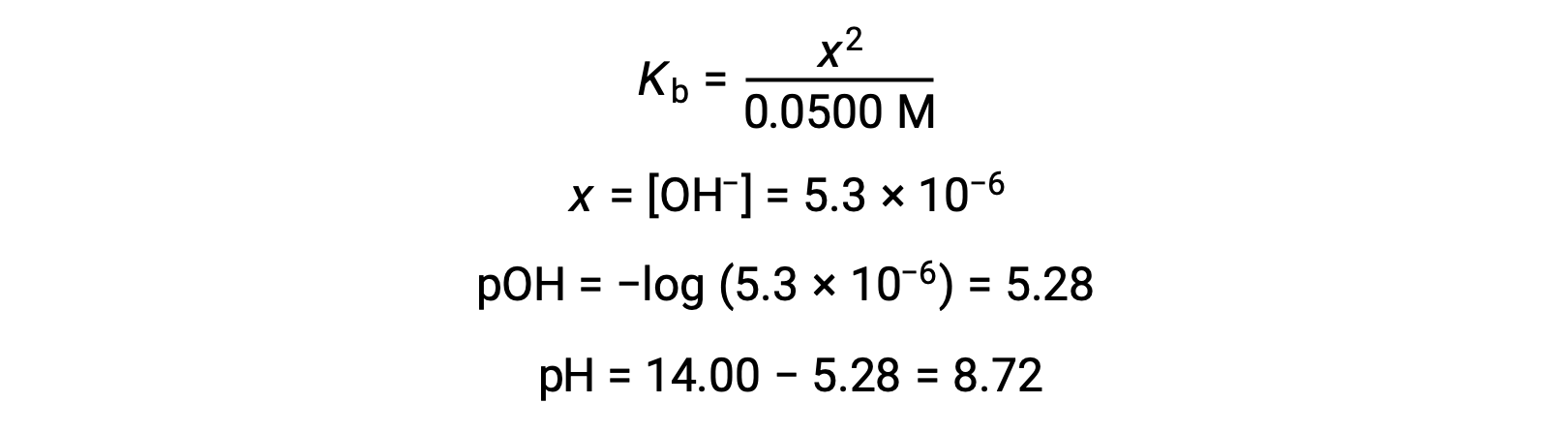
이 적정의 평지에서 pH는 강한 염기와 약한 산을 적중 할 때 예상대로, 7보다 훨씬 큽트 크다.
(c) 적대물 = 12.50 mL. 이 부피는 격자무성의 반을 나타내며, 따라서 아세트산의 절반은 아세테이트 이온의 동등한 양을 산출하기 위해 중화되었다. 따라서 이러한 컨쥬게이트 산염 기반 파트너의 농도는 동일합니다. pH를 계산하는 편리한 접근 방식은 헨더슨-하셀발치 방정식을 사용하는 것입니다.
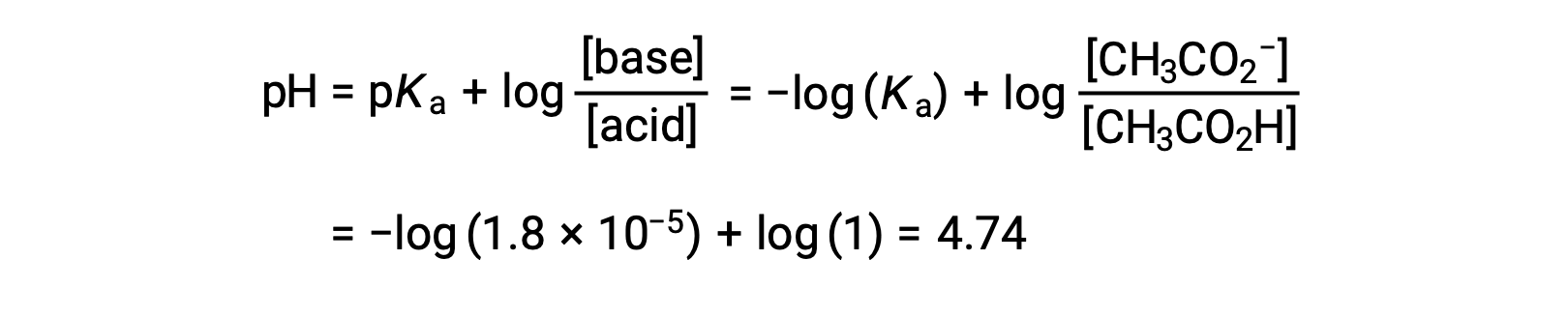
(pH = pKa는 약한 산의 적정에 반 등가 지점에서)
(d) 적대물 = 37.50 mL. 이 부피는 적정 생성물, 아세테이트 이온 및 과도한 강한 적정을 포함하는 반응 용액을 나타내는 강위형 과중량을 나타낸다. 이러한 솔루션에서 솔루션 pH는 주로 과도한 강력한 염기의 양에 의해 결정됩니다.

