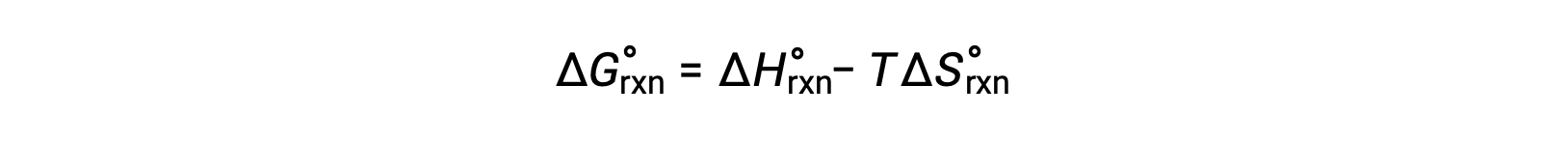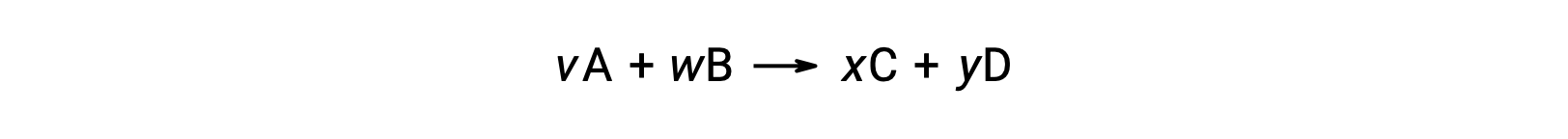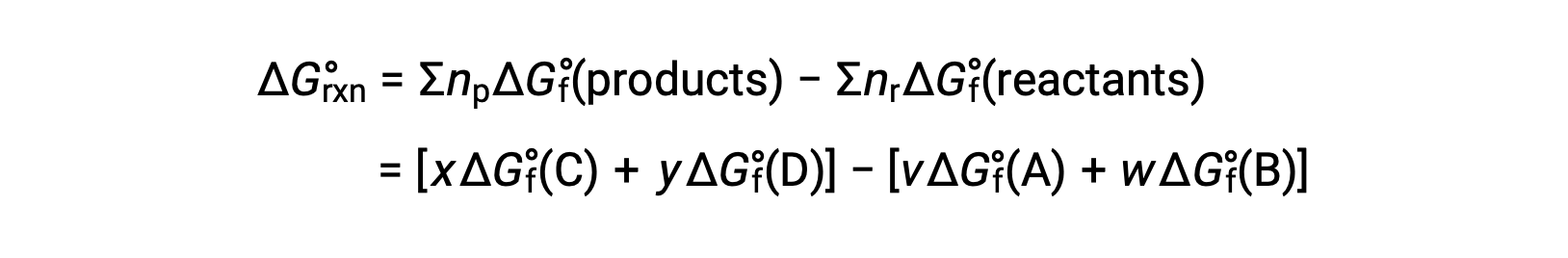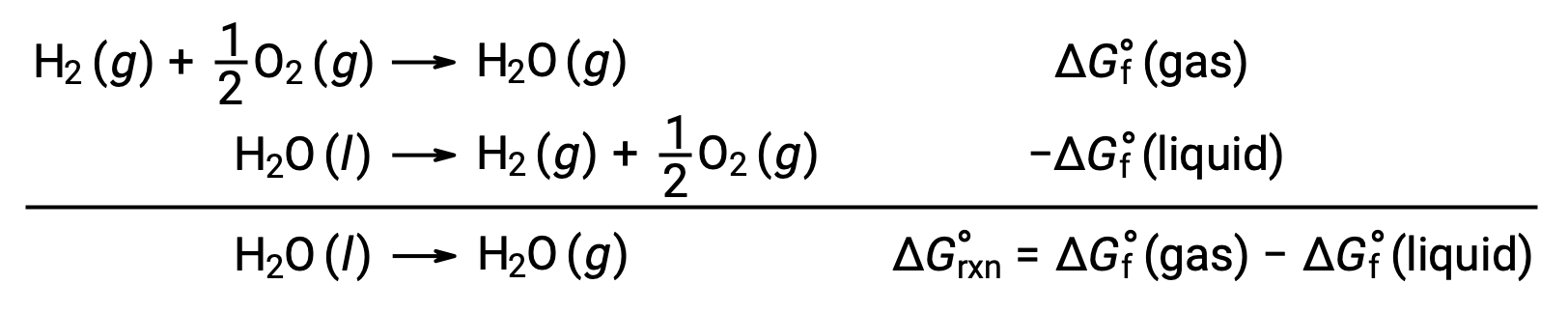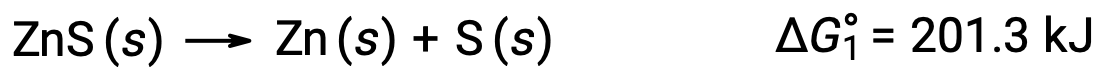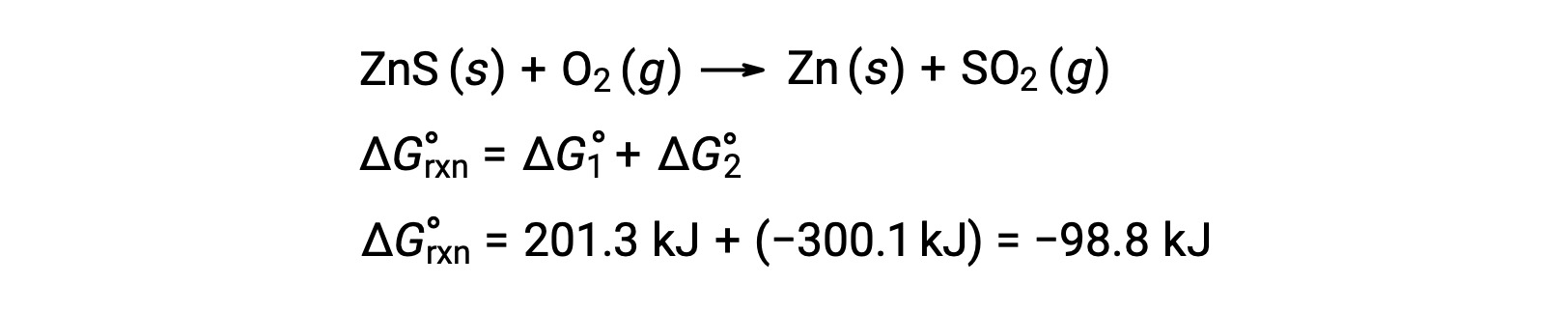The standard free energy change for a chemical reaction occurring under the standard condition can be calculated in one of three ways. The first method uses the equation for the standard ΔG of the reaction. Consider the formation of calcium carbonate from calcium oxide and carbon dioxide. The standard enthalpy change of the reaction can be calculated from the heats of formation of the compounds in the reaction, and the standard entropy change can be calculated from their standard molar entropies. Using the values from the reference tables, the standard enthalpy change and the standard entropy change for the reaction can be determined. Substituting these values into the equation for the change in standard free energy, the standard ΔG of the reaction at 298 K equals −130.7 × 103 J. In the second method, the change in standard free energy of a reaction is calculated from the difference between the sum of the free energies of formation of the products multiplied by their stoichiometric coefficients and the sum of the free energies of formation of the reactants multiplied by their stoichiometric coefficients. Take, for example, the reaction between hydrogen and chlorine gases to form two moles of hydrogen chloride gas. Like the enthalpy of formation, the standard free energy of formation of a pure element is zero. Thus, the free energies of formation of hydrogen and chlorine gases are zero, while that of hydrogen chloride gas is −95.3 kilojoules. So, the free energy of this reaction equals 2 times the free energy of formation of hydrogen chloride gas, or −190.6 kilojoules. Recall from Hess’s law that for a stepwise reaction, the net enthalpy change can be calculated from the sum of the enthalpies of each step. The third method calculates the net free energy change for a reaction in a similar manner. Consider the combustion of zinc sulfide to produce metallic zinc and sulfur dioxide gas, which can be carried out in two steps with known standard free energies. Adding the free energy changes of the reactions gives an overall ΔG of −98.8 kilojoules. Note that step 1 is nonspontaneous. By coupling it with the spontaneous reaction in step 2, the net reaction has a negative ΔG and is therefore spontaneous.