11.21:
格子配置と配位数
11.21:
格子配置と配位数
金属に限らず、結晶性固体の構造は、最も単純な繰り返し単位である単位格子を考えることで理解できます。単位格子は、原子やイオンの位置を表す格子点で構成されています。構造全体は、この単位格子の3次元的な繰り返し構造からなります。立方格子に存在する3種類の単位格子をFigure. 1に示します。
単位格子の種類
多数の同一の球体を容器に均一に並べ、ある層が下の層の球体の真上に来るようにしたとします。このような配置を単純立方構造といい、その単位格子を単純立方格子といいます。単純立方構造では、球体同士はそれほど密でなく、容器の体積の約52%しか充填されていない
このような配列の原子は、その層の4つの最近接原子、上層の真上の原子、下層の真下の原子としか接触しません。結晶性固体中の各粒子が接触する他の原子の数を配位数といいます。単純な立方体として配列しているポロニウム原子の場合、配位数は6となります。
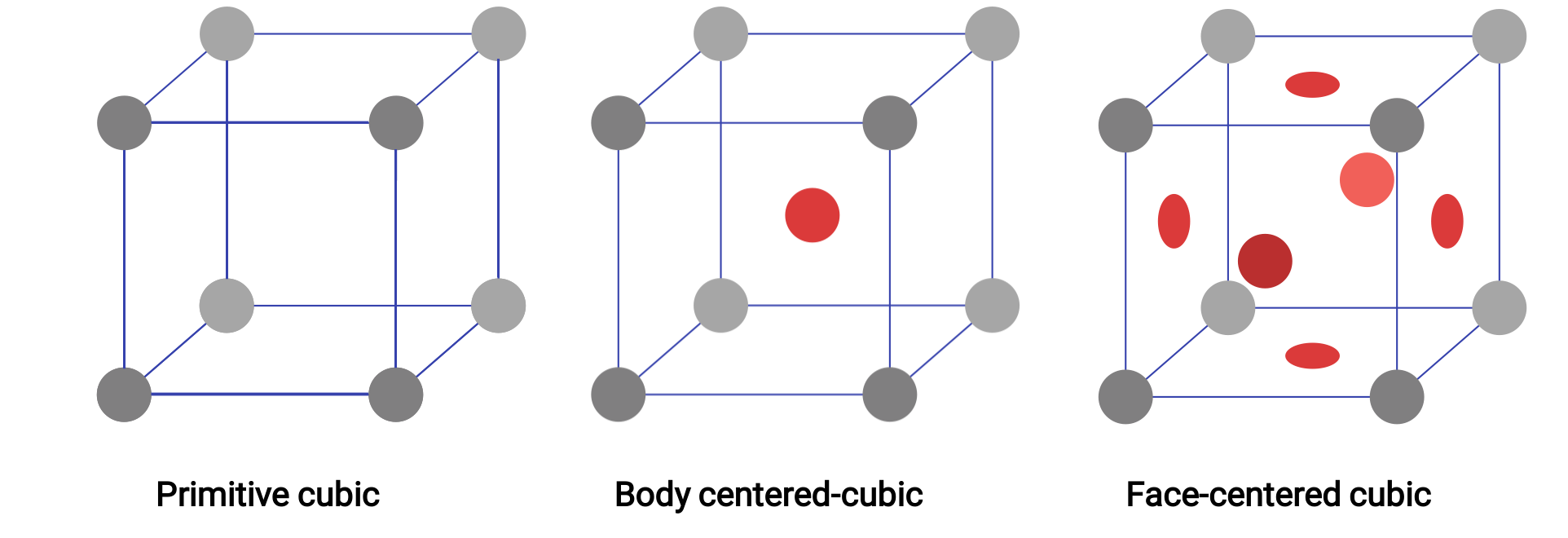
Figure 1.立方格子系における3つの異なる結晶構造
単純立方格子では、すべての方向に繰り返される単位格子は、8個の原子を頂点として定義される立方体です。この単位格子の隣り合う角にある原子は互いに接触しているため、立方体の単位格子はその中にある原子の部分だけを含んでいます。単純立方格子の単位格子の角にある原子は、合計8つの単位格子に含まれているため、その原子の8分の1だけが特定の単位格子に入っていることになります。そして、各単純立方格子の8つの “頂点”にはそれぞれ1つの原子があるので、1つの単純立方格子の中には8 ×1/8=1つの原子があることになります。
金属の中には、すべての頂点に原子があり、中心にも原子がある立方体の単位格子を持つ配列で結晶化するものがあります。これを体心立方構造(BCC)といいます。BCC単位格子の角の原子はお互いに接触せず、中心の原子に接触します。BCC単位格子には、8つの角にある8分の1の原子(8 × 1/8 = 角にある合計1つの原子)と、中心から1つの原子の合計2つの原子が含まれています。この構造では、どの原子も上層の4つの原子と下層の4つの原子に接しています。したがって、BCC構造の原子の配位数は8です。BCC構造の原子は、単純な立方体構造よりもより効率よく充填されており、全体積の約68%を占める
他の多くの金属は、すべての角と各面の中心に原子がある立方体の単位格子を持つ配列で結晶化します。この配列を面心立方構造(FCC)といいます。FCCの単位格子には、8つの角に8分の1個の原子(8 × 1/8 = 角には計1つの原子)、6つの面に2分の1個の原子(6 × 1/2 = 面から計3つの原子)の計4個の原子が含まれています。角にある原子は、立方体の面の対角線に沿って隣接する面の中心にある原子と接しています。これらの原子は同一の格子点上にあるため、同一の環境です。FCC配列の原子は可能な限り密集しており、体積の74%を原子が占めています。各原子は、同一層の6つの原子、上層の3つの原子、下層の3つの原子に接しているため、配位数は12となります。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Sections 10.5 The Solid State of Matter, and 10.6 Lattice Structures in Crystalline Solids.
