Expérience profil bioénergétique utilisant cellules C2C12 de myoblastes
Summary
Une description d'une méthode de profilage de la fonction mitochondriale dans les cellules est fournie. Le profil mitochondrial généré fournit quatre paramètres de la fonction mitochondriale qui peuvent être mesurées dans une expérience: le taux de respiration basale, l'ATP lié respiration, fuite de protons, et la capacité de réserve.
Abstract
La capacité de mesurer le métabolisme cellulaire et comprendre la dysfonction mitochondriale, a permis aux scientifiques du monde entier pour faire avancer leurs recherches dans la compréhension du rôle de la fonction mitochondriale dans l'obésité, la toxicité diabète, le vieillissement, le cancer, la fonction cardiovasculaire et de sécurité.
Le métabolisme cellulaire est le processus d'absorption du substrat, comme l'oxygène, glucose, acides gras, et la glutamine, et la conversion d'énergie subséquente à travers une série d'oxydation enzymatique contrôlée et les réactions de réduction. Ces résultats biochimiques intracellulaires réactions dans la production d'ATP, la libération des sous-produits de la chaleur et de produits chimiques, tels que le lactate et le CO 2 dans le milieu extracellulaire.
Des informations précieuses sur l'état physiologique des cellules, et l'altération de l'état de ces cellules, peuvent être acquises grâce à la mesure du taux d'oxygène consommée par les cellules, un indicateur de la respiration mitochondriale – le taux de consommation d'oxygène – ou OCR. Cellules aussi générer l'ATP par la glycolyse, à savoir: la conversion du glucose en lactate, indépendant de l'oxygène. Dans les puits de culture, le lactate est la principale source de protons. Mesure de l'acide lactique produit indirectement via protons libérés dans le milieu extracellulaire entourant les cellules, ce qui provoque une acidification du milieu fournit la vitesse d'acidification extra-cellulaires – ou de l'ECAR.
Dans cette expérience, cellules C2C12 myoblastes sont ensemencées à une densité donnée en plaques Seahorse culture cellulaire. La consommation d'oxygène basale (OCR) et l'acidification extracellulaire (ECAR) les taux sont mesurés pour établir les taux de base. Les cellules sont ensuite métaboliquement perturbé par trois additions de composés différents (successivement) qui déplacent le profil bioénergétique de la cellule.
Ce test est dérivé d'une expérience classique pour évaluer les mitochondries et sert de cadre qui permet de construire des expériences plus complexes visant à comprendre la fonction à la fois physiologiques et physiopathologiques de la mitochondrie et de prédire la capacité des cellules à répondre au stress et / ou des insultes.
Protocol
Discussion
Ce test est dérivé de l'expérience classique de sonder la fonction mitochondriale et sert de cadre qui permet de construire des expériences plus complexes visant à comprendre divers changements dans le métabolisme cellulaire, la fonction mitochondriale, et bioénergétique global.
Tous les composés utilisés dans cette expérience doit être optimisé pour la concentration qui donne l'effet maximal. Autrement dit, on doit effectuer des expériences de titration séparée de vérifier ces valeurs. Ceci est particulièrement important avec FCCP, comme la courbe de titrage tendance à être assez forte, et FCCP trop peut effectivement diminuer les réponses dans l'OCR. Gammes typiques (concentrations finales) pour tester serait:
- 0,1 à 1,0 ug / ml de oligomycine
- 0,1 à 5,0 uM FCCP
- 0,1 à 1,0 uM roténone
Notez que les réponses à chaque composé ci-dessus (surtout FCCP) sera influencée par la composition de dosage des médias (type de base, [glucose], [pyruvate], présence / absence de BSA, etc.) En outre, si le dosage des médias XF composition est modifiée, l'optimisation devra être ré-exécuté. La présence et la concentration du pyruvate est particulièrement important dans l'obtention de la capacité respiratoire maximale en raison de FCCP. Seahorse Bioscience a observé dans un certain nombre de lignes de cellules que l'omission de la pyruvate abroge la capacité des cellules à répondre au maximum (au-dessus de base) à FCCP. Généralement, les concentrations de pyruvate 1-10 mm doivent être testés pour comprendre la concentration optimale de pyruvate pour obtenir la respiration maximale. Notez que [pyruvate] ET [glucose] peut être nécessaire de "cross-titré" pour obtenir les conditions optimales pour l'expérience des médias.
Les résultats typiques de cette expérience sont présentés ci-dessous un graphique montrant l'OCR en fonction du temps et une autre montrant ECAR en fonction du temps:
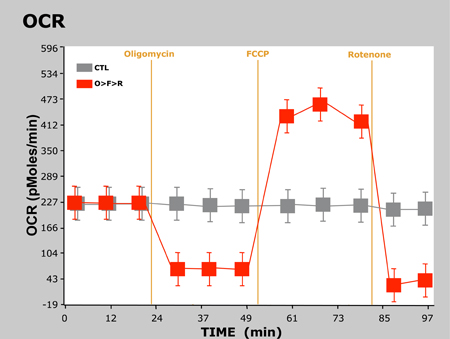
Figure 2. OCR vs Temps
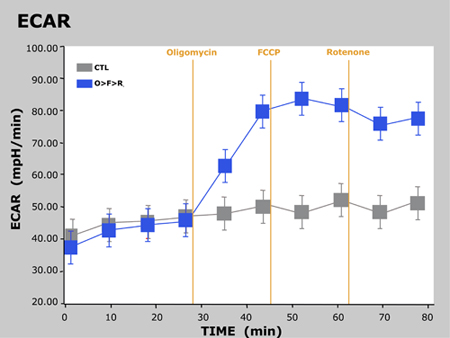
Figure 3. ECAR vs Temps
Ici, nous avons observé les réponses attendues dans les OCR et ECAR que les cellules sont traitées avec chaque composé successives. Pour oligomycine, ROC diminue en raison du blocage de synthèse d'ATP mitochondriale au Complexe V. Puisque les cellules sont incapables de synthétiser l'ATP par OXPHOS, ils reviennent à la glycolyse pour répondre à leur demande de l'ATP, ce que nous observons une augmentation de l'ECAR. Comme indiqué précédemment, FCCP agit comme un agent de découplage. Puisque les cellules doivent désormais surmonter la fuite de protons à travers la membrane mitochondriale interne, ROC augmente de manière significative que plus d'O2 est consommée pour pomper l'excès de protons de retour à travers la membrane mitochondriale. Enfin, la roténone inhibe complexe mitochondrial I et complexe III, respectivement, ce qui provoque un flux d'électrons à cesser de la chaîne de transport des électrons, et donc la consommation d'O2 est drastiquement réduit.
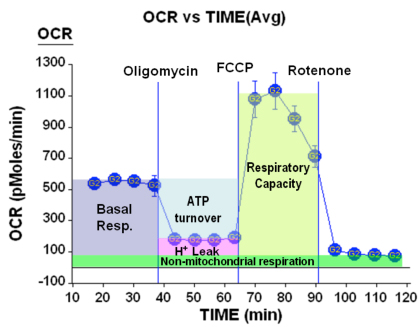
Figure 4. Respiration paramètres
Au-delà des changements attendus dans la respiration et ECAR, un certain nombre de paramètres respiratoires peuvent être obtenus à partir de ces données. Ceci est résumé dans la figure ci-dessus:
Ici, nous voyons que nous pouvons obtenir des renseignements au sujet de la respiration basale des cellules, la consommation d'O2 pour cent de la production consacrée à l'ATP ainsi que le montant consacré au maintien de la gradient de protons (ions H + en raison de fuites). En outre, nous pouvons obtenir la fréquence respiratoire maximale dans des conditions de la respiration découplée (parfois appelé capacité respiratoire comme pièce de rechange) et enfin, nous pouvons déterminer le montant de la consommation d'O2 n'est pas due à des processus mitochondriaux.
Un nombre rapidement croissant d'études employant ce profil mitochondrial pour évaluer la bioénergétique cellulaire, d'identifier un dysfonctionnement mitochondrial et de prédire la capacité des cellules à répondre au stress et / ou des insultes. Pour de plus amples informations et détails sur cette méthode expérimentale et l'idée de la capacité respiratoire de secours, s'il vous plaît se référer à voir les publications suivantes 1-8.
Divulgations
The authors have nothing to disclose.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Oligomycin, FCCP, Rotenone and Antimycin A Solutions | Seahorse Bioscience | Seahorse Mito Stress Test Kit | ||
| DMEM Running Media | Seahorse Bioscience | 100965-000 | ||
| DMSO | Sigma | D8418 | ||
| Distilled Water | Gibco | 15230-170 | ||
| Calibration buffer | Seahorse Bioscience |
References
- Choi, W. S., Gerencser, A. A., Nicholls, D. G. Bioenergetic analysis of isolated cerebrocortical nerve terminals on a microgram scale: spare respiratory capacity and stochastic mitochondrial failure. J Neurochem. 109, 1179-1191 (2009).
- Hill, B. G., Dranka, B. P., Zou, L., Chatham, J. C., Darley-Usmar, V. Importance of the bioenergetic reserve capacity in response to cardiomyocyte stress induced by 4-hydroxynonenal. Biochem J. 424, 99-107 (2009).
- Liu, J., Cao, L., Chen, J., Song, S., Lee, I. H., Quijano, C., Liu, H., Keyvanfar, K., Chen, H. Bmi1 regulates mitochondrial function and the DNA damage response pathway. Nature. , 459-7245 (2009).
- Malmgren, S., Nicholls, D. G., Taneera, J., Bacos, K., Koeck, T., Tamaddon, A., Wibom, R., Groop, L., Ling, C., Mulder, H., Sharoyko, V. V. Tight coupling between glucose and mitochondrial metabolism in clonal beta-cells is required for robust insulin secretion. J Biol Chem. 284, 32395-32404 (2009).
- Dranka, B. P., Hill, B. G., Darley-Usmar, V. M. Mitochondrial reserve capacity in endothelial cells: The impact of nitric oxide and reactive oxygen species. Free Radic Biol Med. 48, 905-914 (2010).
- Perez, J., Hill, B. G., Benavides, G. A., Dranka, B. P., Darley-Usmar, V. M. Role of cellular bioenergetics in smooth muscle cell proliferation induced by platelet-derived growth factor. Biochem J. 428, 255-267 (2010).
- Morán, M., Rivera, H., Sánchez-Aragó, M., Blázquez, A., Merinero, B., Ugalde, C., Arenas, J., Cuezva, J. M., Martín, M. A. Mitochondrial bioenergetics and dynamics interplay in complex I-deficient fibroblasts. Biochim Biophys Acta. , 1802-185 (2010).
- Cárdenas, C., Miller, R. A., Smith, I., Bui, T., Molgó, J. Essential regulation of cell bioenergetics by constitutive InsP3 receptor Ca2+ transfer to mitochondria. Cell. , 142-142 (2010).

