संवर्धन और NRCC पैच दबाना चिप्स पर कक्ष के इलैक्ट्रोफिजियोलॉजी
Summary
हम बताते हैं कैसे planar पैच – दबाना चिप्स कनाडा के राष्ट्रीय अनुसंधान परिषद निष्फल कर रहे हैं, से primed, मध्यम के साथ भरी हुई है, कोशिकाओं के साथ चढ़ाया, गढ़े और electrophysiological रिकॉर्डिंग के लिए इस्तेमाल किया.
Abstract
Due to its exquisite sensitivity and the ability to monitor and control individual cells at the level of ion channels, patch-clamping is the gold standard of electrophysiology applied to disease models and pharmaceutical screens alike 1. The method traditionally involves gently contacting a cell with a glass pipette filled by a physiological solution in order to isolate a patch of the membrane under its apex 2. An electrode inserted in the pipette captures ion-channel activity within the membrane patch or, when ruptured, for the whole cell. In the last decade, patch-clamp chips have been proposed as an alternative 3, 4: a suspended film separates the physiological medium from the culture medium, and an aperture microfabricated in the film replaces the apex of the pipette. Patch-clamp chips have been integrated in automated systems and commercialized for high-throughput screening 5. To increase throughput, they include the fluidic delivery of cells from suspension, their positioning on the aperture by suction, and automated routines to detect cell-to-probe seals and enter into whole cell mode. We have reported on the fabrication of a silicon patch-clamp chip with optimized impedance and orifice shape that permits the high-quality recording of action potentials in cultured snail neurons 6; recently, we have also reported progress towards interrogating mammalian neurons 7. Our patch-clamp chips are fabricated at the Canadian Photonics Fabrication Centre 8, a commercial foundry, and are available in large series. We are eager to engage in collaborations with electrophysiologists to validate the use of the NRCC technology in different models. The chips are used according to the general scheme represented in Figure 1: the silicon chip is at the bottom of a Plexiglas culture vial and the back of the aperture is connected to a subterranean channel fitted with tubes at either end of the package. Cells are cultured in the vial and the cell on top of the probe is monitored by a measuring electrode inserted in the channel.The two outside fluidic ports facilitate solution exchange with minimal disturbance to the cell; this is an advantage compared to glass pipettes for intracellular perfusion.
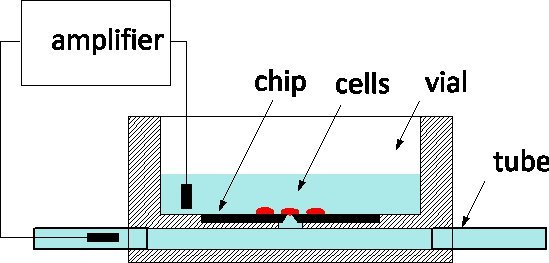
Figure 1. Principle of measurement using the NRCC patch-clamp chip
We detail here the protocols to sterilize and prime the chips, load them with medium, plate them with cells, and finally use them for electrophysiological recordings.
Protocol
Discussion
NRCC चिप पैच – दबाना पूछताछ मंच उच्च जानकारी सामग्री दवा assays के लिए एक संभावित शक्तिशाली उपकरण है और रोग के इन विट्रो मॉडल में जांच. कांच pipettes की तुलना में अपने फायदे कम उपयोग प्रतिरोध है, जो एक बड़े कोशिकाओं की जांच के लिए एक लाभ है, और कुछ हद तक एक बड़ा समाई के बावजूद छोटे कोशिकाओं के लिए तुलनीय गतिशीलता में परिणाम देगा. एपर्चर जवानों सहज सेल नियमित रूप से प्राप्त किया है, और पूरे सेल प्रविष्टि सहज 14 देखा गया है. चिप्स और ग्लास विंदुक विधि के बीच एक स्पष्ट अंतर यह है कि सेल संस्कृति पकवान की जांच हिस्सा है और मैन्युअल रूप से कोशिका झिल्ली के साथ संपर्क में नहीं लाया है. संवर्धन कोशिकाओं, कार्यात्मक नेटवर्क का हिस्सा संभवतः, रोग मॉडल के रूप में अधिक biologically प्रासंगिक मॉडल में परिणाम है, और उच्च सेल हासिल करने के लिए 16 जवानों की जांच के लिए एक अलग तंत्र. हालांकि, सेल निलंबन के साथ इसके विपरीत द्वारा, आकांक्षा cannoजांच पर एक सेल की स्थिति में इस्तेमाल किया जा. घोंघा न्यूरॉन्स, अन्य बड़े कोशिकाओं के रूप में, जांच के शीर्ष पर मैनुअल स्थिति के लिए उत्तरदायी हैं. पर कोशिकाओं के छोटे कोशिकाओं अब संस्कृति समय की आवश्यकता के लिए, हम किसी भी हेरफेर की जरूरत नहीं रही है और जांच की शीर्ष जांच के शीर्ष पर कोशिकाओं के स्थान पर patterning के आसंजन polypeptides द्वारा मुहर प्राप्त करने का एक उच्च संभावना रखने, और प्रदर्शन प्लेसमेंट 17,18 जांच.
NRCC भी विकसित कर रहा है एक ग्लास विंदुक के बराबर समाई के साथ एक microfluidic के पैच – दबाना 19 चिप polyimide के. कि परियोजना का अंतिम लक्ष्य एक बहु जांच चिप पैच – दबाना जो कई व्यक्ति आयन 14 चैनलों के प्रस्ताव पर नेटवर्क व्यवहार में लगे न्यूरॉन्स की electrophysiological गतिविधि के साथ – साथ निगरानी की अनुमति देता है. यह विधि एक उच्च संकल्प – बहु इलेक्ट्रोड 20 arrays के पूरक विधि है.
Divulgations
The authors have nothing to disclose.
Acknowledgements
लेखकों के लिए विधानसभा के साथ सहायता के लिए CPFC पर पैच – दबाना चिप्स, और ह्यू ट्रॅन, पिंग झाओ और मैथ्यू Shiu के निर्माण के लिए अलेक्सई Bogdanov स्वीकार करते हैं इच्छा. नवीद सैयद स्वास्थ्य अनुसंधान अनुदान (CIHR) की कनाडा संस्थान द्वारा समर्थित किया गया. कोलिन Luk NSERC और अलबर्टा विरासत फाउंडेशन के लिए चिकित्सा अनुसंधान studentships (AHFMR) के प्राप्तकर्ता है.
References
- Walz, W. Patch-Clamp Analysis: Advanced Techniques. Neuromethods. , 38 (2007).
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibers. Nature. 260, 799-802 (1976).
- Behrends, J. C., Fertig, N. Ch. 14: Planar Patch-clamp. Neuromethods. , (2007).
- Fertig, N., Tilke, A., Blick, R. H. Stable integration of isolated cell membrane patches in a nanomachined aperture. Applied Physics Letters. 77, 1218-1220 (2000).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and hysiology. Nat. Rev. Drug. Discov. 7 (4), 358-368 (2008).
- Py, C., Denhoff, M., Martina, M. A novel silicon patch-clamp chip permits high-fidelity recording of ion channel activity from functionally defined neurons. Biotechnology and Bioengineering. 107 (4), 593-600 (2010).
- Martinez, D., Martina, M., Kremer, L. Development of patch-clamp chips for mammalian cell applications. Micro and Nanosystems. 2 (4), (2010).
- Py, C., Salim, D., Monette, R. Cell to aperture interaction in patch-clamp chips visualized by fluorescence microscopy and focused-ion beam sections. Biotechnology & Bioengineering. 108, 1395-1403 (2011).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Bell, H. J., Syed, N. I. Hypoxia-induced modulation of the respiratory CPG. Frontiers in bioscience : a journal and virtual library. 14, 3825-3835 (2009).
- Syed, N. I., Bulloch, A. G. M., Lukowiak, K. In vitro reconstruction of the respiratory central pattern generator of the mollusk Lymnaea. Science. 250, 282-285 (1990).
- Syed, N. I., Zaidi, H., Lovell, P., Windhorst, U., Johansson, H. In vitro reconstruction of neuronal circuits: A simple model system approach. Modern techniques in neuroscience research. , (1999).
- Martina, M., Luk, C., Py, C. Interrogation of Cultured Neurons using Patch-Clamp Chips. Journal of Neural Engineering. 8, 034002 (2011).
- Py, C., Denhoff, M., Martina, M., et al. Silicon patch-clamp chip suitable for high-fidelity recording of ion channel activity from cultured neurons. Biotechnology and Bioengineering. 107 (4), (2010).
- Ong, W. -. L., Yobas, L., Ong, W. -. Y. A missing factor in chip-based patch clamp assay: gigaseal. Journal of Physics: Conference Series. 34, 187 (2006).
- Charrier, A., Martinez, D., Monette, R. Cell placement and guidance on substrates for neurochip interfaces. Biotechnology and Bioengineering. 105, 368-373 (2010).
- Diaz-Quijada, D., Maynard, C. C. o. m. a. s., Monette, T., Py, R., A, C. K. r. a. n. t. i. s., Mealing, G. Surface Patterning with Chemisorbed Chemical Cues for Advancing Neurochip Applications. Industrial & Engineering Chemistry Research. 50 (17), 10029-10035 (2011).
- Martinez, D., Py, C., Denhoff, M., et al. High-fidelity patch-clamp recordings from neurons cultured on a polymer microchip. Biomedical Microdevices. 12, 977-97 (2010).
- Taketani, M., Baudry, M. . Advances in Network Electrophysiology: Using Multi-Electrode Arrays. , (2006).

