قياس الخواص الميكانيكية للخلايا الحية باستخدام المجهر القوة الذرية
Summary
يوضح هذه الورقة على بروتوكول لتوصيف الخواص الميكانيكية للخلايا الحية عن طريق microindentation باستخدام مجهر القوة الذرية (AFM).
Abstract
الخواص الميكانيكية للخلايا والمصفوفة خارج الخلية (ECM) تلعب دورا هاما في العديد من العمليات البيولوجية بما في ذلك تمايز الخلايا الجذعية، وتشكيل الورم، والتئام الجروح. التغييرات في تصلب الخلايا وECM غالبا ما تكون علامات تغيرات في علم وظائف الأعضاء أو خلية أمراض في الأنسجة. وبالتالي، وصلابة الخلية هو مؤشر لتقييم الوضع من مزارع الخلايا. من بين العديد من الأساليب التطبيقية لقياس صلابة من الخلايا والأنسجة، والصغرى المسافة البادئة باستخدام مجهر القوة الذرية (AFM) يوفر وسيلة لقياس موثوق صلابة من الخلايا الحية. وقد تم تطبيق هذه الطريقة على نطاق واسع لتوصيف صلابة الصغيرة الحجم لمجموعة متنوعة من المواد تتراوح بين السطوح المعدنية إلى الأنسجة البيولوجية لينة والخلايا. المبدأ الأساسي لهذه الطريقة هو أن المسافة البادئة خلية مع تلميح AFM الهندسة المختارة وقياس القوة المطبقة من الانحناء للناتئ فؤاد. تركيب منحنى قوة المسافة البادئة إلى وضع هيرتزL للهندسة طرف المقابل يمكن أن تعطي قياسات كمية من صلابة المواد. يوضح هذا الإجراء ورقة لتوصيف صلابة من الخلايا الحية باستخدام AFM. وأظهرت الخطوات الرئيسية بما في ذلك عملية AFM المعايرة، واكتساب قوة منحنى، وتحليل البيانات باستخدام MATLAB الروتينية. وتناقش أيضا القيود المفروضة على هذه الطريقة.
Introduction
الخصائص الميكانيكية، خصوصا صلابة، من الخلايا الفردية ومصفوفات المحيطة بهم خارج الخلية (ECM) هي الحاسمة بالنسبة لكثير من العمليات البيولوجية بما في ذلك نمو الخلايا، حركية، وتقسيم، والتمايز، وتوازن الأنسجة. 1 وقد ثبت أن صلابة ميكانيكية الخلية يتحدد أساسا من قبل الهيكل الخلوي، وخصوصا شبكات الأكتين وخيوط الوسيطة وغيرها من البروتينات المرتبطة بها. 2 من نتائج الإختبارات الميكانيكية للشبكات في المختبر من الأكتين وخيوط الوسيطة تشير إلى أن ميكانيكا خلية يعتمد إلى حد كبير على الهيكل هيكل الخلية وقبل الإجهاد في ثم يعتبر الهيكل الخلوي. 3-5 تصلب الخلايا الحية وذلك في مؤشر لتقييم هيكل هيكل الخلية 6، النشاط الميوسين 7 والعديد من العمليات الخلوية الأخرى. الأهم من ذلك، وأيضا كثيرا ما وجدت تغيرات في الخواص الميكانيكية الخلية ليكون associ عن كثبانبعاث العوادم مع الحالات المرضية المختلفة مثل تشكيل الورم والانبثاث 8-10 الرصد وبالتالي يمكن للصلابة الميكانيكية للخلايا الحية توفر وسيلة جديدة لمراقبة فسيولوجيا الخلية؛ لكشف وتشخيص الأمراض 8؛ وتقييم فعالية العلاج بالعقاقير 11 ، 12
وقد تم تطوير طرق متعددة بما في ذلك microrheology الجسيمات تتبع، 13-16 المغناطيسي الخلوي التواء، 17 micropipette تطلع 18،19 وmicroindentation 20-22 لقياس مرونة من الخلايا. الجسيمات تتبع microrheology يتتبع الاهتزازات الحرارية إما جزيئات الفلورسنت submicron حقنها في الخلايا أو علامات إيمانية داخل الهيكل الخلوي الخلية. تحسب 23 خصائص المرونة واللزوجة من الخلايا من التشريد الجسيمات قياسها باستخدام نظرية تقلب تبديد. 14،23 يسمح هذا الأسلوب القياسات في وقت واحد من المحليةالخواص الميكانيكية لقرار مكانية عالية في أماكن مختلفة في خلية. ومع ذلك، حقن جزيئات الفلورسنت في الخلايا قد تؤدي إلى تغييرات في وظيفة الخلوية وبناء الهيكل الخلوي، وبالتالي آليات الخلية. طريقة الرشف micropipette ينطبق الضغط السلبي في micropipette من بقطر يتراوح من 1 إلى 5 ميكرون حتى تمتص قطعة صغيرة من غشاء الخلية في ماصة. يتم احتساب صلابة خلية من الضغط السلبي التطبيقية وغشاء الخلية تشوه. 18 هذا الأسلوب، ومع ذلك، لا يمكن الكشف عن التوزيع غير متجانسة من صلابة عبر الخلية. الخلوي التواء المغناطيسي (MTC) ينطبق المجال المغناطيسي لتوليد عزم الدوران على الخرز ممغطس السوبر تعلق على غشاء الخلية. مشتق 17 صلابة الخليوي في هذا الأسلوب من العلاقة بين عزم الدوران التطبيقية وتشوه التواء من غشاء الخلية. فمن الصعب السيطرة على الموقع من الخرز المغناطيسي في طريقة MTC، وأنه هو أيضا challengiنانوغرام لتوصيف تشوه التواء مع ارتفاع القرار. Microindentation ينطبق على إندينتر مع هندسة واضحة المعالم لكمة في الخلية. قوة الطعج والمسافة البادئة الناتجة في الخلايا غالبا ما تتبع التنبؤ للنموذج هيرتز. ويمكن حساب معاملات الرجوعية الشباب من الخلايا من منحنيات قوة المسافة البادئة من المناسب لهم لنموذج هيرتز. وقد تم تطبيق هذه الطريقة على نطاق واسع لاختبار الخواص الميكانيكية للأنسجة وخلايا رغم من حدودها مثل عدم اليقين في تحديد نقطة الاتصال، انطباق نموذج هيرتز، والقدرة على الإضرار بدنيا الخلايا. من بين العديد من الأجهزة لmicroindentaion 20، مجهر القوة الذرية (AFM) متاحة تجاريا وأنها طبقت على نطاق واسع لتوصيف الخواص الميكانيكية للخلايا الحية والأنسجة 21،24-27.
يوضح هذا الإجراء من ورقة باستخدام اللجوء MFP3D بيو AFM لتوصيف ميكانيكا الخلية. AFM ليس علىيوفر لاي تضاريس عالية الدقة من الخلايا ولكن أيضا تم تطبيقه على نطاق واسع لتوصيف الخواص الميكانيكية للخلايا الأنسجة. ويتضح مبدأ AFM المسافة البادئة في الشكل 1. ناتئ AFM تقترب الخلية من بضعة ميكرومتر أعلاه؛ يجعل الاتصال مع الخلية؛ المسافات البادئة الخلية بحيث انحراف ناتئ تصل إلى نقطة مجموعة انتقاؤه، وتسحب بعيدا عن الخلية. أثناء هذه العملية يتم تسجيل انحراف ناتئ بوصفها وظيفة من موقعه كما هو مبين في الشكل 1. قبل إجراء الاتصال مع الخلية، ينتقل ناتئ في الوسط دون أي انحراف واضح. عندما الطعج على الخلية، والانحناءات ناتئ والزيادات إشارة انحراف. وعلى غرار الكابولي كما الحزمة مرنة بحيث انحراف بهم يتناسب مع القوة المطبقة على الخلية. عن طريق تحديد الحد الأقصى للانحراف ناتئ، والحد الأقصى لحجم القوة المطبقة على عينة محدودة لتجنب Damage إلى الخلايا. جزء من منحنى القوة من نقطة إلى نقطة ب ج في الشكل 1، حيث المسافات البادئة طرف في الخلية، ولا يصلح لنموذج هيرتز لاستخراج صلابة الخلية.
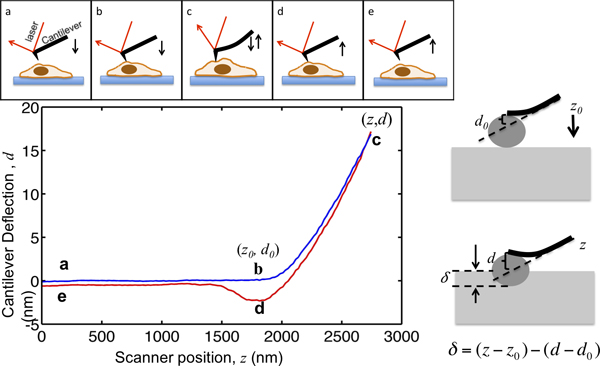
الشكل 1. التوضيح من AFM microindentation وتفسير منحنى القوة. لوحة العلوي يظهر حركة AFM ناتئ مدفوعا الماسح الضوئي بيزو. يتم تسجيل موقع العمودي ناتئ Z وناتئ انحراف إشارة د أثناء العملية. يبدأ ناتئ من النقطة (أ)، وعدد قليل ميكرومتر أعلى الخلية. بينما تقترب الخلية، يبقى δ المسافة البادئة عينة الصفر حتى يصل إلى نقطة (ب)، حيث يأتي في اتصال مع طرف الخلية. إحداثيات النقطة (ب) في المؤامرة هي القيم الحرجةلتحليل البيانات، يشار إليه ب (Z 0، د 0>). من B إلى C، البادئة ناتئ في الخلية حتى انحراف ناتئ تصل إلى نقطة المجموعة، والتي من المقرر أن تكون النسبة بين الحد الأقصى الطعج القوة المستهدفة والربيع ناتئ المستمر. مرة واحدة في إشارة انحراف تصل القيمة القصوى محددة مسبقا، ثم يتم سحب ناتئ من الخلية إلى نقطة التطوير، حيث أنه غالبا ما يتم سحبها إلى الأسفل بسبب التصاق بلاغ عينة، يفصل من الخلية ويعود إلى المكان الأولي في البريد. يوضح اللوحة اليمنى العلاقة بين المسافة البادئة وZ المسجلة وإشارة د. في على اللوحة اليسرى السفلى هو مؤامرة من منحنى ممثل القوة، والحد الأقصى المسافة البادئة من ناتئ، من الذي يقاس ثابت الربيع ليكون 0.07N / م، ومن المقرر أن يكون 17 نانومتر بحيث الحد الأقصى للقوة الطعج تطبيقها على العينة 1.2 ن ن. يتم وضع علامة على المواقع الرئيسية خلال المسافة البادئة.
Protocol
Representative Results
Discussion
الأسلوب المسافة البادئة AFM له مزايا لتوصيف الخواص الميكانيكية للخلايا الحية. وإن كان أقل حساسية من الخلوي التواء المغناطيسي وملاقط بصرية، والتي يمكن قياس القوى على مستوى piconewton 32، يمكن للAFM كشف قوة المقاومة من عينات تتراوح بين عشرات بيكو نيوتن لمئات من النانو ن?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
الكتاب أشكر الدكتور بول Janmey في جامعة ولاية بنسلفانيا لتوفير خطوط الخلايا المستخدمة في هذه الورقة. QW نعترف أيضا JF في Byfield وايفان اندرسون للمناقشات الثاقبة على تقنيات AFM.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

