Het meten van de mechanische eigenschappen van levende cellen door gebruik Atomic Force Microscopy
Summary
Deze paper toont een protocol om de mechanische eigenschappen van levende cellen te karakteriseren door middel van microindentation gebruik van een Atomic Force Microscope (AFM).
Abstract
Mechanische eigenschappen van cellen en extracellulaire matrix (ECM) spelen een belangrijke rol in vele biologische processen waaronder stamcel differentiatie, tumorvorming en wondgenezing. Veranderingen in stijfheid van cellen en ECM vaak tekenen van veranderingen in celfysiologie of ziektes in weefsels. Daarom cel stijfheid is een index om de status van celkweken evalueren. Onder de vele methoden die aan de stijfheid van cellen en weefsels te meten, micro-inkeping met een Atomic Force Microscope (AFM) biedt een manier om betrouwbare wijze de stijfheid van levende cellen. Deze methode is op grote schaal toegepast op de micro-schaal stijfheid karakterisering van verschillende materialen, variërend van metalen oppervlakken zachte biologische weefsels en cellen. Het basisprincipe van deze werkwijze is om een cel inspringen met een AFM tip van geselecteerde geometrie en meet de uitgeoefende kracht de buiging van de AFM cantilever. Montage van de kracht-inkeping bocht naar de Hertz-modusl voor de bijbehorende tip geometrie kunnen kwantitatieve metingen van het materiaal stijfheid te geven. Deze paper toont de procedure om de stijfheid van levende cellen met behulp van AFM karakteriseren. Belangrijkste stappen waaronder het proces van de AFM kalibratie, kracht-curve acquisitie en data-analyse met behulp van een MATLAB routine worden gedemonstreerd. Beperkingen van deze methode worden ook besproken.
Introduction
Mechanische eigenschappen, met name stijfheid van afzonderlijke cellen en de omliggende extracellulaire matrix (ECM) zijn essentieel voor vele biologische processen zoals celgroei, motiliteit, celdeling, differentiatie en weefsel homeostase. 1 Het is aangetoond dat cellen mechanische stijfheid mate wordt bepaald door het cytoskelet, vooral de netwerken van actine en intermediaire filamenten en andere eiwitten gekoppeld. 2 Resultaten van de mechanische testen van de in vitro netwerken van actine en intermediaire filamenten suggereren dat de cel mechanica is grotendeels afhankelijk van de cytoskelet structuur en de voorspanning in het cytoskelet. 3-5 Stijfheid van levende cellen wordt vervolgens beschouwd als een index om de cytoskelet structuur 6, myosine activiteit 7 en vele andere cellulaire processen te evalueren. Belangrijker, veranderingen in cel mechanische eigenschappen vaak blijkt nauw associated met diverse aandoeningen zoals tumorvorming en metastase 8-10 Monitoring de mechanische stijfheid van levende cellen kan derhalve een nieuwe manier om celfysiologie volgen;. te detecteren en diagnosticeren ziekten 8;. en de doeltreffendheid van geneesmiddelen behandelingen evalueren 11 , 12
Meerdere werkwijzen waaronder deeltjes volgen microrheology, 13-16 magnetische verdraaien cytometry, 17 micropipet aspiratie 18,19 en microindentation 20-22 zijn ontwikkeld om de elasticiteit van de cellen te meten. Deeltje volgen microrheology traceert de thermische trillingen van beide submicrondeeltjes fluorescerende deeltjes geïnjecteerd in cellen of ijkmarkeringen in de cel cytoskelet. 23 Elastisch en visceuze eigenschappen van cellen worden berekend op basis van de gemeten deeltjes verplaatsingen met de fluctuatie-dissipatie theorema. 14,23 Deze methode maakt gelijktijdige metingen van lokalemechanische eigenschappen met een hoge ruimtelijke resolutie op verschillende plaatsen in een cel. Echter, injecteren fluorescerende deeltjes in cellen kan leiden tot veranderingen in cellulaire functie, cytoskelet structuur en dus de cel mechanics. De micropipet aspiratie methode is onderdruk in een micropipet met een diameter van 1 tot 5 urn op een klein stukje celmembraan zuigen in de pipet. Cell stijfheid wordt berekend uit de toegepaste onderdruk en celmembraan vervorming. 18 Deze werkwijze kan echter niet de ongelijkmatige verdeling van de stijfheid over de cel te detecteren. Magnetische twisting cytometrie (MTC) van toepassing magnetisch veld koppel aan super paramagnetische beads bevestigd aan het celmembraan genereren. Cell 17 stijfheid wordt verkregen in deze werkwijze van de relatie tussen de toegepaste torsie en de kronkelende vervorming van de celmembraan. Het is moeilijk om de locatie van de magnetische korrels in de werkwijze MTC controleren, en het is ook challenging tot de kronkelende vervorming met een hoge resolutie te karakteriseren. Microindentation geldt een indenter met goed gedefinieerde geometrie om punch in de cel. Het inspringen kracht en de resulterende inspringen in cellen volgen vaak de voorspelling van de Hertz-model. Young's moduli van de cellen kan worden berekend uit de kracht-indrukking curven aanpassen ervan aan de Hertz model. Deze methode is op grote schaal toegepast op de mechanische eigenschappen van de weefsels en cellen te testen, ondanks zijn beperkingen, zoals onzekerheid in contactpunt vastberadenheid, toepasbaarheid van de Hertz-model, en het potentieel om fysiek te beschadigen de cellen. Onder de vele apparaten voor microindentaion 20, de Atomic Force Microscope (AFM) is in de handel verkrijgbaar en is op grote schaal toegepast op de mechanische eigenschappen van levende cellen en weefsels 21,24-27 karakteriseren.
Deze paper toont de procedure van het gebruik van een asiel MFP3D-Bio AFM naar cel mechanica karakteriseren. AFM niet oply levert hoge-resolutie topografie van cellen, maar ook op grote schaal toegepast om de mechanische eigenschappen van weefselcellen karakteriseren. Het principe van AFM indrukking wordt geïllustreerd in figuur 1. De AFM cantilever nadert de cel van enkele micrometers hierboven, maakt contact met de cel streepjes de cel zodat de cantilever doorbuiging een voorgeselecteerd setpunt bereikt, en trekt vanaf de cel. Tijdens dit proces wordt de cantilever doorbuiging wordt geregistreerd als een functie van de locatie zoals weergegeven in figuur 1. Alvorens contact met de cel, de cantilever beweegt het medium zonder enige duidelijke afwijking. Wanneer inspringen op de cel, de cantilever bochten en de afbuigsignaal toeneemt. De cantilevers worden gemodelleerd als elastische balken zodat hun afbuiging evenredig is met de op het cel kracht. Door het instellen van de maximale cantilever doorbuiging, is de maximale grootte van de kracht toegepast op de steekproef beperkt tot d voorkomenAmage aan cellen. Het gedeelte van de kracht curve van punt b in figuur 1, waarbij de punt streepjes in de cel, is bekwaam tot het hertz model om de cel stijfheid extraheren naar punt c.
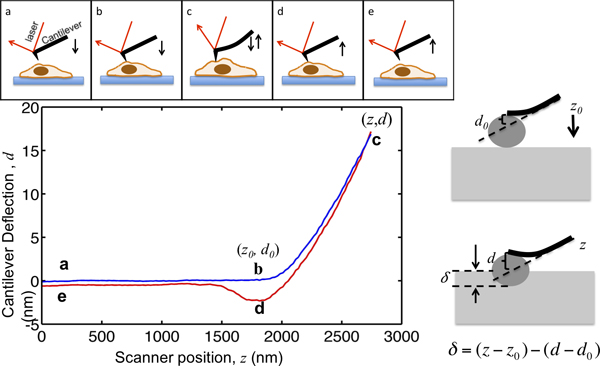
Figuur 1. Illustratie van de AFM microindentation en interpretatie van de geldende curve. Het bovenste paneel toont de beweging van AFM cantilever gedreven door de piëzo-scanner. De verticale locatie van cantilever z en cantilever uitwijkingssignaal d wordt geregistreerd gedurende het proces. De cantilever begint vanaf punt een, enkele micrometers boven de cel. Bij het naderen van de cel, het monster inkeping δ blijft nul tot het punt b, wanneer de punt in contact komt met de cel bereikt. De coördinaten van punt b in de plot zijn kritieke waardenvoor gegevensanalyse, aangeduid met (z 0, d 0>). Van b naar c, de cantilever streepjes in de cel totdat de cantilever doorbuiging bereikt een instelling, die is ingesteld op de verhouding tussen de beoogde maximum inspringen kracht en de cantilever veerconstante zijn. Zodra de afbuigsignaal de ingestelde maximale waarde heeft bereikt, wordt de cantilever vervolgens teruggetrokken uit de cel naar punt d, waar het vaak naar beneden worden getrokken als gevolg van tip-sample adhesie, los van de cel en keert terug naar zijn oorspronkelijke locatie bij e. Het rechter paneel toont de relatie tussen de inkeping en de opgenomen z en d signaal. In op de lagere linker paneel is een plot van een representatieve kracht curve, de maximale inspringen van een cantilever, waarvan de veerconstante wordt gemeten om te 0.07N / m, is ingesteld om 17 nm, zodat de maximale inspringen kracht toegepast op steekproef is 1.2 nN. De belangrijkste locaties tijdens de insprong zijn gemarkeerd.
Protocol
Representative Results
Discussion
De AFM inspringen methode heeft voordelen om mechanische eigenschappen van levende cellen te karakteriseren. Zij het minder gevoelig is dan de magnetische draaiende cytometrie en optische pincetten, welke krachten kunnen meten op het piconewton level 32, kan de AFM weerstandskracht detecteren van monsters, variërend van enkele tientallen pico-Newton tot honderden nano-Newton, vergelijkbaar met variëren van kracht die kunnen worden toegepast op cellen met behulp van een micropipet 19. Deze r…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De auteurs danken dr. Paul Janmey aan de Universiteit van Pennsylvania voor het verstrekken van cellijnen die in deze paper. QW ook erkennen JF Byfield en Evan Anderson voor hun inzichtelijke discussies over AFM technieken.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

