परमाणु शक्ति माइक्रोस्कोपी का प्रयोग जीवित कोशिकाओं के यांत्रिक गुण मापने
Summary
यह कागज का एक परमाणु सेना माइक्रोस्कोप (AFM) का उपयोग microindentation के माध्यम से जीवित कोशिकाओं के यांत्रिक गुणों को चिह्नित करने के लिए एक प्रोटोकॉल को दर्शाता है.
Abstract
कोशिकाओं और बाह्य मैट्रिक्स (ईसीएम) के यांत्रिक गुण स्टेम सेल भेदभाव, ट्यूमर गठन, और घाव भरने सहित कई जैविक प्रक्रियाओं में महत्वपूर्ण भूमिका निभाते हैं. कोशिकाओं और ईसीएम की कठोरता में परिवर्तन अक्सर सेल फिजियोलॉजी या ऊतकों में रोगों में परिवर्तन के संकेत मिल रहे हैं. इसलिए, सेल कठोरता सेल संस्कृतियों की स्थिति का मूल्यांकन करने के लिए एक सूचकांक है. कोशिकाओं और ऊतकों की कठोरता को मापने के लिए लागू विधियों की भीड़ के बीच में, एक परमाणु सेना माइक्रोस्कोप (AFM) का उपयोग सूक्ष्म खरोज मज़बूती से जीवित कोशिकाओं की कठोरता को मापने के लिए एक तरीका प्रदान करता है. इस पद्धति का व्यापक रूप से धातु सतहों से मुलायम जैविक ऊतकों और कोशिकाओं से लेकर सामग्री की एक किस्म के लिए सूक्ष्म पैमाने पर कठोरता चिह्नित करने के लिए लागू किया गया है. इस विधि के बुनियादी सिद्धांत चयनित ज्यामिति के एक AFM टिप के साथ एक सेल इंडेंट और AFM ब्रैकट के झुकने से लागू बल को मापने के लिए है. हर्ट्ज मोड पर बल खरोज वक्र फिटिंगइसी टिप ज्यामिति के लिए एल सामग्री कठोरता की मात्रात्मक माप दे सकते हैं. इस पत्र AFM का उपयोग जीवित कोशिकाओं की कठोरता को चिह्नित करने की प्रक्रिया को दर्शाता है. एक MATLAB दिनचर्या का उपयोग कर AFM के अंशांकन की प्रक्रिया, बल वक्र अधिग्रहण, और डेटा विश्लेषण सहित महत्वपूर्ण कदम का प्रदर्शन कर रहे हैं. इस विधि की सीमाओं पर भी चर्चा कर रहे हैं.
Introduction
व्यक्ति की कोशिकाओं और उनके आसपास के बाह्य matrices के यांत्रिक गुणों, विशेष रूप से कठोरता, (ईसीएम) सेल के विकास, गतिशीलता, विभाजन, भेदभाव, और ऊतक homeostasis सहित कई जैविक प्रक्रियाओं के लिए महत्वपूर्ण हैं. 1 यह सेल यांत्रिक कठोरता मुख्य रूप से निर्धारित होता है कि प्रदर्शन किया गया है actin और मध्यवर्ती तंतु की इन विट्रो नेटवर्क पर यांत्रिक परीक्षण से cytoskeleton, actin और मध्यवर्ती तंतु और उनके साथ जुड़े अन्य प्रोटीन की विशेष रूप से नेटवर्क. 2 परिणाम सेल यांत्रिकी में cytoskeletal संरचना और पूर्व तनाव पर काफी हद तक निर्भर है कि सुझाव cytoskeleton है. जीवित कोशिकाओं के 3-5 अकड़न तो cytoskeletal संरचना 6, मायोसिन गतिविधि 7 और कई अन्य सेलुलर प्रक्रियाओं का मूल्यांकन करने के लिए एक सूचकांक के रूप में माना जाता है. इससे भी महत्वपूर्ण बात, सेल यांत्रिक गुणों में परिवर्तन भी अक्सर निकट एसोसिएशन होना पाया जाता हैइस तरह के ट्यूमर गठन और मेटास्टेसिस के रूप में विभिन्न बीमारी की स्थिति के साथ पैदा 8-10 निगरानी जीवित कोशिकाओं के यांत्रिक कठोरता इसलिए सेल फिजियोलॉजी नजर रखने के लिए एक उपन्यास तरीका प्रदान कर सकते हैं;. का पता लगाने और रोगों 8 निदान करने के लिए,. और दवा उपचार के प्रभाव का मूल्यांकन करने के लिए 11 , 12
कण ट्रैकिंग microrheology, 13-16 चुंबकीय घुमा cytometry, 17 micropipette आकांक्षा 18,19 और microindentation 20-22 सहित कई तरीकों कोशिकाओं की लोच को मापने के लिए विकसित किया गया है. कण ट्रैकिंग microrheology सेल cytoskeleton अंदर कोशिकाओं या मापकला मार्करों में इंजेक्शन submicron फ्लोरोसेंट कणों या तो थर्मल कंपन बताते हैं. कोशिकाओं के 23 लोचदार और चिपचिपा गुण अस्थिरता अपव्यय प्रमेय का उपयोग करके मापा कण विस्थापन से गणना कर रहे हैं. 14,23 इस विधि की अनुमति देता है स्थानीय के साथ मापएक कक्ष में विभिन्न स्थानों पर उच्च स्थानिक संकल्प के साथ यांत्रिक गुणों. हालांकि, कोशिकाओं में फ्लोरोसेंट कणों इंजेक्शन लगाने सेलुलर समारोह में परिवर्तन, cytoskeleton संरचना, और इसलिए सेल यांत्रिकी को जन्म दे सकती है. micropipette आकांक्षा विधि पिपेट में कोशिका झिल्ली का एक छोटा सा टुकड़ा चूसना करने के लिए 1 से 5 माइक्रोन से लेकर व्यास की एक micropipette में नकारात्मक दबाव लागू होता है. सेल कठोरता लागू नकारात्मक दबाव और कोशिका झिल्ली विरूपण. 18 इस विधि से गणना की है, तथापि, सेल भर में जकड़न की विषम वितरण का पता नहीं लगा सकते हैं. चुंबकीय घुमा cytometry (MTC) कोशिका झिल्ली से जुड़ी सुपर paramagnetic मोती पर टोक़ उत्पन्न करने के लिए चुंबकीय क्षेत्र पर लागू होता है. 17 सेल कठोरता लागू टोक़ और कोशिका झिल्ली की घुमा विरूपण के बीच रिश्ते से इस विधि में प्राप्त होता है. यह MTC विधि में चुंबकीय मोतियों के स्थान को नियंत्रित करने के लिए मुश्किल है, और यह भी challengi हैउच्च संकल्प के साथ घुमा विरूपण चिह्नित करने के लिए एनजी. Microindentation सेल में पंच के लिए अच्छी तरह से परिभाषित ज्यामिति के साथ एक indenter लागू होता है. indenting बल और कोशिकाओं में जिसके परिणामस्वरूप खरोज अक्सर हर्ट्ज मॉडल की भविष्यवाणी का पालन करें. कोशिकाओं के युवा moduli हर्ट्ज मॉडल के लिए उन्हें फिटिंग द्वारा बल खरोज घटता से गणना की जा सकती. इस पद्धति का व्यापक रूप से इस तरह के संपर्क बिंदु दृढ़ संकल्प, हर्ट्ज मॉडल की प्रयोज्यता, और शारीरिक रूप से कोशिकाओं को नुकसान करने की क्षमता में अनिश्चितता के रूप में अपनी सीमाओं के बावजूद ऊतक और कोशिकाओं के यांत्रिक गुणों का परीक्षण करने के लिए लागू किया गया है. Microindentaion 20 के लिए कई उपकरणों के अलावा, परमाणु सेना माइक्रोस्कोप (AFM) व्यावसायिक रूप से उपलब्ध है और व्यापक रूप से जीवित कोशिकाओं और ऊतकों 21,24-27 के यांत्रिक गुणों को चिह्नित करने के लिए लागू किया गया है.
इस कागज सेल यांत्रिकी चिह्नित करने के लिए एक शरण MFP3D जैव AFM का उपयोग की प्रक्रिया को दर्शाता है. AFM के नहीं परly कोशिकाओं की उच्च संकल्प स्थलाकृति प्रदान करता है, लेकिन यह भी व्यापक रूप से ऊतक कोशिकाओं के यांत्रिक गुणों को चिह्नित करने के लिए लागू किया गया है. AFM के खरोज के सिद्धांत चित्र 1 में सचित्र है. AFM ब्रैकट ऊपर कुछ माइक्रोमीटर से सेल दृष्टिकोण, सेल के साथ संपर्क में आता है, इंडेंट सेल ब्रैकट विक्षेपन एक चुने हुए सेट बिंदु तक पहुँच जाता है ताकि, और दूर सेल से खींचती है. चित्र 1 में दिखाया के रूप में इस प्रक्रिया के दौरान ब्रैकट विक्षेपन अपने स्थान के एक समारोह के रूप में दर्ज है. सेल के साथ संपर्क बनाने से पहले, ब्रैकट कोई स्पष्ट विक्षेपन बिना माध्यम में चलता रहता है. सेल, ब्रैकट झुकता है और विक्षेपन संकेत बढ़ जाती है पर indenting है. cantilevers उनके विक्षेपन सेल को लागू बल के समानुपाती होता है कि इतना लोचदार मुस्कराते हुए के रूप में मॉडलिंग कर रहे हैं. अधिकतम ब्रैकट विक्षेपन की स्थापना करके, नमूना के लिए लागू बल की अधिकतम परिमाण घ से बचने के लिए सीमित हैकोशिकाओं को amage. सेल में टिप इंडेंट, सेल कठोरता निकालने के लिए हर्ट्ज मॉडल के लिए फिट है जहां चित्रा 1, में ग स्थल से स्थल ख से बल वक्र का भाग.
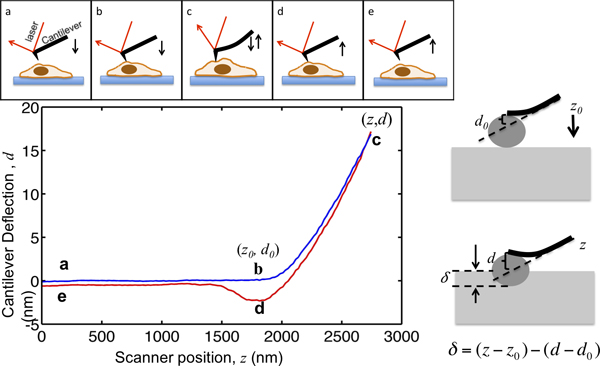
चित्रा 1. AFM के microindentation और बल वक्र की व्याख्या का चित्रण. शीर्ष पैनल पीजो स्कैनर द्वारा संचालित AFM ब्रैकट की गति का पता चलता है. ब्रैकट z और ब्रैकट विक्षेपन संकेत घ के ऊर्ध्वाधर स्थान प्रक्रिया के दौरान दर्ज की गई है. ब्रैकट बिंदु एक, सेल ऊपर कुछ माइक्रोमीटर से शुरू होता है. सेल आ जबकि यह टिप सेल के संपर्क में आता है, जहां बिंदु ख पहुँचता है, जब तक नमूना खरोज δ शून्य रहता है. साजिश में बिंदु ख के निर्देशांक महत्वपूर्ण मान रहे हैंडेटा विश्लेषण के लिए, (जेड 0, डी 0>) से चिह्नित. ख से ग के लिए, सेल में ब्रैकट इंडेंट ब्रैकट विक्षेपन लक्षित अधिकतम indenting शक्ति और निरंतर ब्रैकट वसंत के बीच अनुपात होना तय है जो एक सेट बिंदु तक पहुँच जाता है जब तक. विक्षेपन संकेत पूर्व निर्धारित अधिकतम मूल्य तक पहुँच जाता है, ब्रैकट तो, सेल से यह अक्सर टिप नमूना आसंजन के कारण नीचे की ओर खींचा जा बिंदु जहां घ, को वापस ले लिया सेल और रिटर्न से ई में अपनी आरंभिक स्थान पर detaches है. सही पैनल खरोज और दर्ज z और घ के संकेत के बीच संबंध दिखाता है. निचले बाएँ पैनल पर में वसंत लगातार एम / 0.07N हो मापा जाता है, जिनमें से एक प्रतिनिधि बल वक्र, एक ब्रैकट की अधिकतम खरोज,, की एक साजिश है अधिकतम indenting शक्ति को लागू किया ताकि 17 एनएम होना तय है नमूना 1.2 एन है. खरोज दौरान प्रमुख स्थानों के रूप में चिह्नित कर रहे हैं.
Protocol
Representative Results
Discussion
AFM के खरोज विधि जीवित कोशिकाओं के यांत्रिक गुणों को चिह्नित करने के फायदे हैं. Piconewton 32 के स्तर पर बलों के उपाय कर सकते हैं जो चुंबकीय घुमा cytometry और ऑप्टिकल चिमटी, की तुलना में कम संवेदनशील देरी, AFM के बल से ल…
Divulgations
The authors have nothing to disclose.
Acknowledgements
लेखकों ने इस पत्र में इस्तेमाल सेल लाइनों प्रदान करने के लिए पेन्सिलवेनिया विश्वविद्यालय में डॉ. पॉल Janmey धन्यवाद. QW भी AFM के तकनीक पर उनके व्यावहारिक विचार विमर्श के लिए जेएफ Byfield और इवान एंडरसन को स्वीकार करते हैं.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

