Måling av mekaniske egenskaper Living Cells hjelp Atomic Force Mikroskopi
Summary
Denne artikkelen viser en protokoll for å karakterisere de mekaniske egenskapene til levende celler ved hjelp av microindentation ved hjelp av en Atomic Force Microscope (AFM).
Abstract
Mekaniske egenskapene til celler og ekstracellulære matrix (ECM) spiller viktige roller i mange biologiske prosesser, inkludert stamceller differensiering, svulst formasjon, og sårtilheling. Endringer i stivhet av celler og ECM er ofte tegn på endringer i celle fysiologi eller sykdommer i vev. Derfor er celle stivhet en indeks for å vurdere status av cellekulturer. Blant de mange metoder som er anvendt for å måle stivheten av celler og vev, gir mikro-skår med en Atomic Force mikroskop (AFM) en driftsikker måte å måle stivheten av levende celler. Denne metoden har blitt mye brukt for å karakterisere den mikro-skala stivhet til en rekke materialer, som strekker seg fra metalloverflater til mykt biologisk vev og celler. Det grunnleggende prinsippet om denne metoden er å rykke inn en celle med en AFM spissen av valgt geometri og måle anvendt kraft fra bøying av AFM cantilever. Montering av kraft-innrykk kurven til Hertz-modusl for tilsvarende spiss geometri kan gi kvantitative målinger av vesentlig stivhet. Denne artikkelen viser prosedyren for å karakterisere stivhet i levende celler ved hjelp av AFM. Viktige trinn, blant annet prosessen med AFM kalibrering, kraft-kurve erverv og dataanalyse ved hjelp av en MATLAB rutine blir demonstrert. Begrensninger av denne metoden blir også diskutert.
Introduction
Mekaniske egenskaper, spesielt stivhet, av individuelle celler og deres omkringliggende ekstracellulære matriser (ECM) er kritisk for mange biologiske prosesser, inkludert cellevekst, motilitet, divisjon, differensiering og vev homeostase. 1. Det har vist seg at celle mekanisk stivhet bestemmes i hovedsak av cytoskjelettet, spesielt nettverk av aktin og mellomliggende filamenter og andre proteiner knyttet til dem. 2 Resultater fra mekaniske tester på in vitro nettverk av aktin og mellomliggende filamenter tyder på at cellen mekanikk er i stor grad avhengig av cytoskeletal struktur og pre-stress i cytoskjelettet. 3-5 Stivhet av levende celler blir da regnet som en indeks for å vurdere cytoskeletal struktur 6, myosin aktivitet 7 og mange andre cellulære prosesser. Enda viktigere, er endringer i celle mekaniske egenskaper også ofte funnet å være nært tilknyttedererte med ulike sykdomstilstander som tumor dannelse og metastase 8-10 Overvåking mekanisk stivhet i levende celler kan derfor gi en ny måte å overvåke cellefysiologi;. å oppdage og diagnostisere sykdommer 8;., og å evaluere effektiviteten av medikamentell behandling 11 , 12
Flere metoder, inkludert partikkel-sporing microrheology, 13-16 magnetisk kronglete cytometry, 17 micropipette aspirasjon 18,19 og microindentation 20-22 har blitt utviklet for å måle elastisitet av celler. Partikkel sporing microrheology sporer de termiske vibrasjoner av enten submicron fluorescerende partikler sprøytet inn celler eller fiducial markører inne i cellen cytoskjelettet. 23 Elastiske og viskøse egenskaper til celler er beregnet ut fra de målte partikkel forskyvninger ved hjelp av svingning-spredning teorem. 14,23 Denne metoden gjør samtidige målinger av lokalemekaniske egenskaper med høy romlig oppløsning på forskjellige steder i en celle. Imidlertid kan injisere fluorescerende partikler inn i cellene føre til endringer i cellulære funksjon, cytoskeleton struktur, og dermed cellen mekanikk. Mikropipette aspirasjon metoden gjelder undertrykk i en mikropipette med diameter i området 1-5 um for å suge en liten del av cellemembranen inn i pipetten. Cell stivhet beregnes ut fra den anvendte undertrykk og cellemembranen deformasjon. 18. Denne metoden er imidlertid ikke detekterer den heterogene fordeling av stivheten på tvers av cellen. Magnetisk vridning cytometri (MTC) gjelder magnetisk felt for å generere dreiemoment på super paramagnetiske kuler festet til cellemembranen. Cell 17 stivhet er avledet på denne måte fra forholdet mellom den anvendte dreiemoment og den vridning deformasjon av cellemembranen. Det er vanskelig å kontrollere plasseringen av magnetiske kuler ved MTC-metoden, og det er også challenging for å karakterisere den ikke vrir deformasjon med høy oppløsning. Microindentation gjelder en indenter med veldefinerte geometri å slå inn i cellen. Den innrykk kraft og den resulterende innrykk i cellene ofte følger prediksjon av Hertz modell. Youngs moduli av celler kan beregnes ut fra den kraft-skår kurver ved å montere dem på Hertz-modellen. Denne metoden har blitt mye brukt for å teste de mekaniske egenskaper av vev og celler til tross for sine begrensninger som usikkerhet i kontaktpunkt bestemmelse, anvendelse av modellen Hertz, og potensialet for fysisk å skade cellene. Blant de mange enheter for microindentaion 20 for fremstilling av Atomic Force mikroskop (AFM) kommersielt tilgjengelige og har vært mye anvendt for å karakterisere mekaniske egenskapene til levende celler og vev 21,24-27.
Denne artikkelen viser fremgangsmåten for å bruke en Asylum MFP3D-Bio AFM å karakterisere cellen mekanikk. AFM ikke påly gir høy oppløsning topografi av celler, men også har blitt mye brukt for å karakterisere de mekaniske egenskapene til vev celler. Prinsippet for AFM skår er illustrert i figur 1.. Den AFM cantilever nærmer cellen fra noen få mikrometer ovenfor, kommer i kontakt med cellen; rykkes cellen slik at bjelkeenden defleksjonen når en på forhånd valgt settpunkt, og trekker bort fra cellen. Under denne prosessen blir frittbærende avbøyning blir registrert som en funksjon av sin plassering som vist i figur 1. Før å ta kontakt med cellen, flyttes cantilever i medium uten noen åpenbar nedbøyning. Når innrykk på cellen, de cantilever svinger og nedbøyning signal øker. De cantilevers modelleres som elastiske bjelker, slik at deres avbøyning er proporsjonal med den kraft som påføres på cellen. Ved å sette den maksimale cantilever avbøyning, er den maksimale størrelse av kraft som påføres prøven er begrenset for å unngå dAmage til cellene. Den del av kurven kraft fra punkt B til punkt C på figur 1, der spissen fordypningene inn i cellen, er skikket til hertz modell for å trekke ut den celle stivhet.
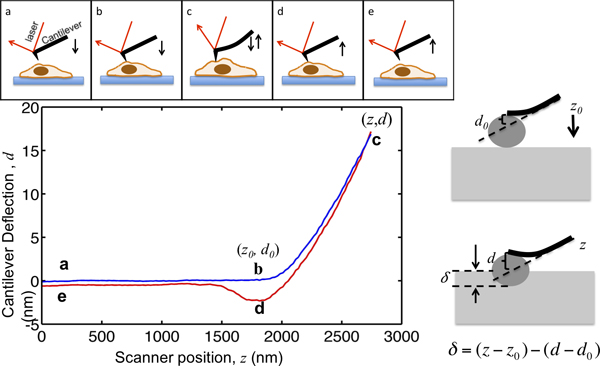
Figur 1. Illustrasjon av AFM microindentation og tolkning av kraften kurven. Den øverste panelet viser bevegelse av AFM cantilever drevet av piezo skanneren. Den vertikale plasseringen av cantilever z og cantilever nedbøyning signal d er registrert under prosessen. Den frittbærende starter fra et punkt, noen få mikrometer over cellen. Mens nærmer celle, forblir prøven skår δ null inntil den når punktet b, der spissen kommer i kontakt med cellen. Koordinatene til punkt b i plottet er kritiske verdierfor data analyse, merket med (z 0, d 0>). Fra B til C, de cantilever innrykk i cellen til det cantilever defleksjonen når et sett punkt, som er satt til å være forholdet mellom målrettet maksimal innrykk kraft og bommene våren konstant. Når nedbøyning signal når forhåndsinnstilt maksimalverdi, blir cantilever så trukket tilbake fra cellen til punktet d, hvor den ofte trekkes nedover på grunn av spiss-sample adhesjon, løsner fra cellen og går tilbake til sin opprinnelige plassering ved e. Høyre panel viser forholdet mellom innsnittet og den innspilte Z og D-signalet. I den nedre venstre panel viser et diagram av en representativ kurve kraft, den maksimale innrykk av en konsoll, hvorav den fjærkonstant er målt til å være 0.07N / m, er satt til å være 17 nm, slik at den maksimale kraft som påføres innrykk prøven er 1,2 nN. De sentrale posisjoner under innrykk er merket.
Protocol
Representative Results
Discussion
Den AFM skår metode har fordeler å karakterisere mekaniske egenskapene til levende celler. Riktignok mindre følsom enn den magnetiske kronglete cytometry og optiske pinsetter, som kan måle krefter på piconewton nivå 32, kan AFM oppdage motstand kraft fra prøver som spenner fra titalls pico-Newton til hundrevis av nano-Newton, kan sammenlignes med alt av kraft som kan anvendes på celler ved hjelp av en mikropipette 19.. Denne serien av makt passer behovene for å skape målbare deformasjoner…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Dr. Paul Janmey ved University of Pennsylvania for å gi cellelinjene som ble brukt i denne artikkelen. QW erkjenner også JF Byfield og Evan Anderson for sine innsiktsfulle diskusjoner om AFM teknikker.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

