Измерение механических свойств живых клеток с помощью атомно-силовой микроскопии
Summary
Эта статья демонстрирует протокол для характеристики механических свойств живых клеток с помощью микроиндентирования с помощью атомно-силового микроскопа (АСМ).
Abstract
Механические свойства клеток и внеклеточного матрикса (ECM) играют важную роль во многих биологических процессах, включая дифференцировку стволовых клеток, образование опухолей, и заживление ран. Изменение жесткости клеток и ECM часто являются признаками изменения в физиологии клеток или заболеваний в тканях. Таким образом, жесткость элемент является индексом для оценки состояния клеточных культур. Среди множества методов, применяемых для измерения жесткость клеток и тканей, микро-отступа использованием атомно-силового микроскопа (АСМ) обеспечивает возможность надежного измерения жесткость живых клеток. Этот способ широко применяется для описания микро-масштабе жесткости для различных материалов, начиная с металлических поверхностей мягкой биологической ткани и клетки. Основной принцип этого метода является создание отступа ячейки с иглой АСМ выбранной геометрии и измерения приложенной силы от изгиба кантилевера АСМ. Установка силового отступы кривой в режим Hertzл для соответствующей геометрии наконечника может дать количественные измерения жесткости материала. Эта статья демонстрирует процедуру для характеристики жесткости живых клетках с помощью АСМ. Ключевые шаги в том числе процесс калибровки АСМ, сила-кривой приобретения, а также анализ данных с использованием обычного MATLAB демонстрируются. Ограничения этого метода также обсуждаются.
Introduction
Механические свойства, особенно жесткости отдельных клеток и окружающей их внеклеточного матрикса (ECM) являются критическими для многих биологических процессов, в том числе рост клеток, подвижность, деление, дифференцировку и тканевого гомеостаза. 1 Было показано, что клетки механическую жесткость в основном определяется цитоскелета, особенно сетей актина и промежуточных филаментов и других белков, связанных с ними. 2 Результаты механических испытаний на сетях в пробирке актина и промежуточных филаментов предполагают, что клетки механика во многом зависит от структуры цитоскелета и предварительного напряжения в цитоскелета. 3-5 Жесткость живых клеток затем рассматривается в качестве индекса для оценки структуры цитоскелета, 6, 7 активность миозина и многих других клеточных процессов. Более того, изменения в клеточной механические свойства также часто оказывается тесно свяated с различными условиями заболеваний, таких как образование опухолей и метастазов 8-10 мониторинга механической жесткости живые клетки, следовательно, обеспечить новый способ контроля клеточной физиологии;. для обнаружения и диагностики заболеваний 8;. а также для оценки эффективности медикаментозного лечения 11 , 12
Несколько методов, включая частицы отслеживания микрореология, 13-16 магнитный цитометрии скручивание, 17 микропипетки стремление 18,19 и микроиндентирования 20-22 были разработаны для измерения эластичности клеток. Микрореология отслеживания частиц прослеживает тепловых колебаний либо флуоресцентные частицы субмикронного вводили в клетки или координатных меток внутри клетки цитоскелета. +23 Упругих и вязких свойств клеток рассчитывается из измеренного смещения частиц использованием ФДТ. 14,23 Этот метод позволяет одновременных измерений местныхмеханических свойств с высоким пространственным разрешением в разных местах в клетке. Тем не менее, инъекционное флуоресцентные частицы в клетки может привести к изменению клеточной функции, структуры цитоскелета, и, следовательно, клетки механики. Метод микропипетки пронизывает отрицательного давления в микропипетки с диаметром в диапазоне от 1 до 5 мкм, чтобы сосать небольшой кусок клеточную мембрану в пипетку. Сотовые жесткость рассчитывают из прикладной отрицательное давление и клеточные мембраны деформации. 18 Этот метод, однако, не может обнаружить неоднородное распределение жесткость по всей клетке. Магнитные цитометрии скручивание (ВТС) применяется магнитное поле для создания крутящего момента на супер шарики парамагнитный прикреплен к клеточной мембране. 17 сотовый жесткости происходит в этом методе из соотношения между приложенным крутящий момент и крутящий деформации клеточной мембраны. Это трудно контролировать расположение магнитных шариков в методе МТС, и это также challengiнг охарактеризовать деформация кручения с высоким разрешением. Микроиндентирования относится индентора с четко определенными геометрии пробить в клетку. Отступов силы и в результате углубление в клетках часто следуют предсказания модели Герца. Модуль Юнга клеток, может быть рассчитана по силе отступа кривые путем установки их в герцах модели. Этот способ широко применяется для проверки механических свойств тканей и клеток, несмотря на его ограничения, такие как неопределенность в точке контакта определение, применимость модели Герца, а также возможность физически повредить клетки. Среди многих устройствах для microindentaion 20, атомно-силовой микроскоп (АСМ) является коммерчески доступной и широко применяется для характеристики механических свойств живых клетках и тканях 21,24-27.
Эта статья демонстрирует порядок использования Asylum MFP3D-Bio AFM охарактеризовать клетку механики. AFM не налы обеспечивает высокое разрешение топографию элементов, но и широко применяется для характеристики механических свойств клеток ткани. Принцип отступа АСМ показано на рисунке 1. АСМ кантилевера приближается клетку от нескольких микрометров выше; вступает в контакт с клеткой; отступы ячейки таким образом, чтобы отклонение кантилевера достигает заданной уставки, и отрывается от клетки. Во время этого процесса изгиба кантилевера записывается в виде функции его расположения, как показано на рисунке 1. , Прежде чем связаться с клеткой, кантилевера движется в среде без видимых отклонений. Когда отступа на клетку, кантилевер изгибам и увеличивает отклонение сигнала. Кантилеверов смоделированы как упругих стержней так, чтобы их отклонение пропорционально силе, приложенной к ячейке. Установив максимальный прогиб кантилевера, максимальная величина силы, приложенной к образцу ограничено, чтобы избежать гAmage к клеткам. Часть силовой кривой из точки В в точку С на рисунке 1, где кончик отступы в клетку, не благонадежен для модели Герца, чтобы извлечь клетки жесткость.
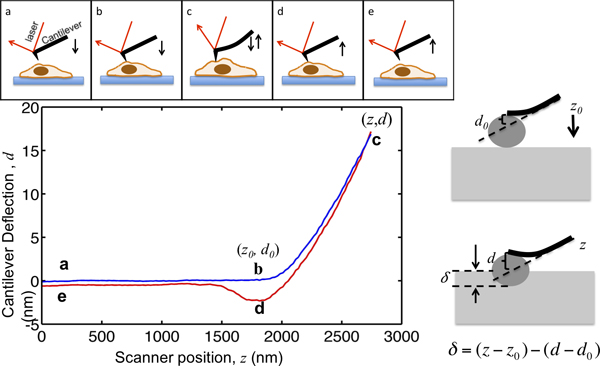
Рисунок 1. Иллюстрация AFM микроиндентирования и интерпретация кривой усилия. Верхней панели показано движение кантилевера АСМ обусловлен сканер пьезо. Вертикальное расположение консольные г и изгиба кантилевера сигнал г записывается в ходе процесса. Консольные начинается от точки, в несколько микрометров выше клетку. При приближении к клетке, δ образец отступа остается равным нулю, пока не достигнет точки В, где кончик входит в контакт с клеткой. Координаты точки B в сюжете критические значениядля анализа данных, обозначаемых (Z 0, D 0>). От В к С, кантилевер отступы в клетку до изгиба кантилевера не достигает заданного значения, которое установлено, что соотношение между целевой максимальный отступа силы и жесткости кантилевера. После отклонения сигнала достигает заданного максимального значения, консольные затем удаляется из клетки к точке D, где она часто вырваться вниз под зонд-образец адгезия, отделяется от клетки и возвращается на прежнее место при Е. На правой панели показана взаимосвязь между углублением и записанного г и г сигнала. В левой нижней панели представляет собой график кривой, силы, максимальный отступ консольные, из которых пружины измеряется быть 0.07N / м, установлен на уровне 17 нм так, чтобы максимальное отступов силы, приложенной к образец 1,2 NN. Ключевые места во время отступа будут отмечены.
Protocol
Representative Results
Discussion
Метод АСМ углубление имеет преимущества, чтобы охарактеризовать механические свойства живых клеток. Хотя и менее чувствительны, чем магнитные цитометрии скручивания и оптический пинцет, который может измерить силы на уровне piconewton 32, АСМ может обнаружить силы сопротивления из о?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят доктора Пола Janmey в Университете Пенсильвании за предоставление клеточные линии, используемые в работе. КЯ также признать JF Байфилд и Эван Андерсон за их проницательный обсуждения методов АСМ.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

