Mätning av mekaniska egenskaper i levande celler Använda Atomkraftsmikroskopi
Summary
Detta dokument visar ett protokoll för att karakterisera de mekaniska egenskaperna hos levande celler genom mikrointryckt använder ett atomkraftsmikroskop (AFM).
Abstract
Mekaniska egenskaper hos celler och extracellulär matris (ECM) spelar viktiga roller i många biologiska processer inklusive stamceller differentiering, tumörbildning, och sårläkning. Förändringar i styvhet av celler och ECM är ofta tecken på förändringar i cellens fysiologi eller sjukdomar i vävnader. Därför är cell stelhet ett index för att utvärdera statusen av cellkulturer. Bland de många metoder som används för att mäta styvheten hos celler och vävnader, ger mikro-indrag använder ett atomkraftsmikroskop (AFM) ett sätt att tillförlitligt mäta styvheten hos levande celler. Denna metod har i stor utsträckning för att karakterisera den mikroskala styvhet för en mängd olika material, från metallytor för att mjuka biologiska vävnader och celler. Den grundläggande principen för denna metod är att dra in en cell med en AFM spets vald geometri och mäta den applicerade kraften från böjningen av AFM fribärande. Montering av kraft-indrag kurva till Hertz-lägetl för motsvarande spets geometri kan ge kvantitativa mätningar av material styvhet. Denna uppsats visar proceduren för att karakterisera styvheten hos levande celler med användning av AFM. Viktiga steg, inklusive arbetet med AFM kalibrering, kraft-kurvan förvärv, och data analys med en MATLAB rutin demonstreras. Begränsningar av denna metod diskuteras också.
Introduction
Mekaniska egenskaper, särskilt styvhet, i enskilda celler och deras omgivande extracellulära matriser (ECM) är kritisk för många biologiska processer, inklusive celltillväxt, motilitet, division, differentiering, och vävnad homeostas. 1 Det har visats att celler mekanisk styvhet i huvudsak bestäms av cytoskeletonen, särskilt de nätverk av aktin och intermediära filament och andra proteiner associerade med dem. 2 Resultat från mekaniska tester på in vitro nätverk av aktin och intermediära filament antyder att cellen mekanik är i hög grad beroende av den cytoskeletal struktur och pre-stress i cytoskelettet. 3-5 Styvhet av levande celler är sedan betraktas som ett index för att utvärdera cytoskelettala strukturen 6, myosin aktivitet 7 och många andra cellulära processer. Ännu viktigare, är förändringar i cellernas mekaniska egenskaper också ofta visat sig vara nära intresseföretagpade med olika sjukdomstillstånd, såsom tumörbildning och metastas 8-10 Övervakning mekanisk styvhet levande celler därför kan ge ett nytt sätt att övervaka cellens fysiologi;. att upptäcka och diagnostisera sjukdomar 8,. samt att utvärdera effektiviteten av läkemedelsbehandling 11 , 12
Flera metoder inklusive partikel-tracking microrheology, 13-16 magnetisk vridning cytometri, 17 mikropipett aspiration 18,19 och mikrointryckt 20-22 har tagits fram för att mäta elasticiteten i cellerna. Particle tracking microrheology spårar termiska vibrationer av antingen submikrona fluorescerande partiklar injiceras i celler eller referensmärken markörer inuti cellen cytoskelettet. 23 Elastiska och viskösa egenskaper hos celler är beräknade från de uppmätta partikel förskjutningar med hjälp av fluktuation-försvinnande sats. 14,23 Denna metod medger samtidiga mätningar av lokalmekaniska egenskaper med hög rumslig upplösning på olika platser i en cell. Dock kan injicera fluorescerande partiklar i celler leda till förändringar i cellulär funktion, cytoskeleton struktur, och därmed även mekanik cell. Den mikropipett aspiration metoden gäller undertryck i en mikropipett med en diameter varierande från 1 till 5 um för att suga en liten bit av cellmembranet in i pipetten. Cell styvhet beräknas från den tillämpade undertryck och cellmembranet deformation. 18 Denna metod är dock inte kan detektera ojämn fördelning av stelhet över cellen. Magnetisk vridning cytometri (MTC) gäller magnetfält för att generera vridmoment på super paramagnetiska kulor fästa till cellmembranet. 17 Cell styvhet härleds i denna metod från sambandet mellan det applicerade momentet och den vridande deformation av cellmembranet. Det är svårt att kontrollera placeringen av magnetiska pärlor i MTC metoden, och det är också challenging att karakterisera vridande deformation med hög upplösning. Mikrointryckt tillämpar en indenter med väldefinierad geometri att stansa in i cellen. Den tandade kraft och den resulterande fördjupning i celler följer ofta förutsägelsen av Hertz modellen. Youngs moduler av celler kan beräknas ur kraft-indrag kurvor genom att montera dem till Hertz modellen. Denna metod har i stor utsträckning för att testa de mekaniska egenskaperna hos vävnader och celler trots av dess begränsningar såsom osäkerhet i kontaktpunkt bestämning, tillämpligheten av Hertz-modellen, och potentialen att fysikaliskt skada cellerna. Bland de många anordningar för microindentaion 20, är den atomkraftsmikroskop (AFM) kommersiellt tillgängliga och har i stor utsträckning för att karakterisera mekaniska egenskaper hos levande celler och vävnader 21,24-27.
Denna uppsats visar förfarandet med att använda en asyl-MFP3D-Bio AFM att karakterisera cell mekanik. AFM inte påly ger hög upplösning topografi av celler men också har i stor utsträckning för att karakterisera de mekaniska egenskaperna hos vävnadsceller. Principen för AFM fördjupning illustreras i figur 1. AFM fribärande närmar cellen från några få mikrometer uppåt, kommer i kontakt med cellen; strecksatserna cellen så att den fribärande avböjning når en förvald uppsättning punkt, och drar bort från cellen. Under denna process fribärande avböjning registreras som en funktion av dess läge som visas i figur 1. Innan kontakt med cellen, förflyttar fribärande i mediet utan någon påtaglig avböjning. När indrag på cellen, de böjer fribärande och deformationen ökar signal. De utliggare modelleras som elastiska balkar så att deras böjning är proportionell mot kraften som anbringas på cellen. Genom att ställa in den maximala fribärande böjning, är den maximala storleken på kraft på provet begränsas för att undvika dAmage till celler. Den del av den kraft kurvan från punkt B till punkt C i Fig. 1, där spetsen strecksatserna in i cellen, är lämplig att den hertz modellen att extrahera cellen styvhet.
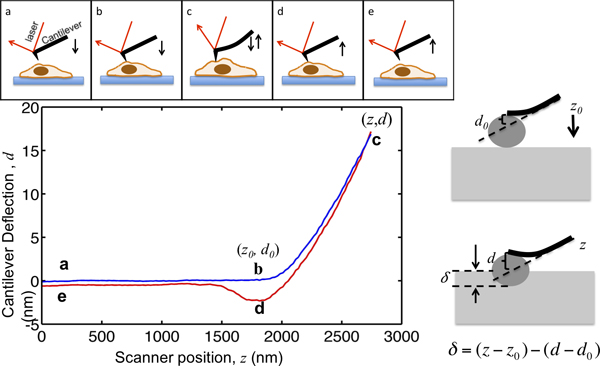
Figur 1. Illustration av AFM mikrointryckt och tolkning av kraftkurvan. Den övre panelen visar rörelsen hos AFM fribärande driven av den piezo skannern. Den vertikala placeringen av fribärande z och den fribärande avböjningssignalen d registreras under processen. Den fribärande startar från punkt a, några mikrometer ovanför cellen. Samtidigt närmar cellen, förblir provet indrag δ noll tills den når punkt b, där spetsen kommer i kontakt med cellen. Koordinaterna för punkten B i komplotten är kritiska värdenför dataanalys, betecknat med (z 0, d 0>). Från B till C, konsolpartierna strecksatserna in i cellen tills den fribärande avböjning når ett börvärde, som är satt att vara kvoten mellan den riktade maximal indraget kraft och den fribärande fjäderkonstant. När avböjningssignalen når det förinställda maximala värdet är fribärande sedan bort från cellen till led d, där det ofta dras nedåt, på grund tip-prov vidhäftning, lossnar från cellen och återgår till sin ursprungliga plats på e. Den högra panelen visar förhållandet mellan fördjupningen och den inspelade z och d-signal. I den nedre vänstra panelen är en plot av en representativ kraftkurva den maximala fördjupningen av en konsol, där fjäderkonstanten mäts vara 0.07N / m, är inställd på att vara 17 nm så att den maximala indraget kraft tillämpas på provet är 1,2 nN. De viktigaste platserna under fördjupningen är markerade.
Protocol
Representative Results
Discussion
AFM indrag metod har sina fördelar att karakterisera mekaniska egenskaper hos levande celler. Än mindre känslig än den magnetiska vrida cytometry och optisk pincett, som kan mäta krafter på piconewton nivå 32, kan AFM upptäcka motståndet kraft från prover som sträcker sig från tiotals pico-Newton till hundratals nano-Newton, jämförbara med allt våld som kan tillämpas på celler med användning av en mikropipett 19. Denna serie av våld passar behoven att skapa mätbara deformationer…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Författarna tackar Dr Paul Janmey vid University of Pennsylvania för att tillhandahålla cellinjer som används i detta dokument. QW erkänner också JF Byfield och Evan Anderson för deras insiktsfulla diskussioner om AFM tekniker.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

