Atomik Kuvvet Mikroskobu kullanarak Yaşam Hücrelerinin Mekanik Özellikleri Ölçme
Summary
Bu kağıt bir atomik kuvvet mikroskobu (AFM) kullanarak microindentation ile canlı hücrelerin mekanik özelliklerini karakterize etmek için bir protokol göstermektedir.
Abstract
Hücre ve hücre dışı matriks (ECM) mekanik özellikleri kök hücre farklılaşması, tümör oluşumu ve yara iyileşmesi gibi birçok biyolojik süreçlerde önemli rol oynar. Hücreler ve ECM sertliği değişiklikler genellikle hücre fizyolojisi veya doku hastalıklarında değişim işaretleri vardır. Bu nedenle, hücre sertlik hücre kültürlerinin durumunu değerlendirmek için bir endekstir. Hücre ve dokuların sertlik ölçmek için uygulanan yöntemler çok sayıda arasında, bir atomik kuvvet mikroskobu (AFM) kullanarak mikro girinti güvenilir canlı hücrelerin sertliği ölçmek için bir yol sağlar. Bu yöntem, yaygın olarak metal yüzeyler yumuşak biyolojik dokular ve hücreler arasında değişen çeşitli malzemeler için mikro ölçekli sertliği karakterize etmek için uygulanmıştır. Bu yöntemin temel prensibi seçilen bir geometri AFM ucu olan bir hücre girinti ve AFM dirsekli bükme ile uygulanan kuvvet ölçmektir. Hertz moduna kuvvet girinti eğrisi takılmasıilgili uç geometrisi l malzeme sertliği kantitatif ölçümler verebilir. Bu kağıt AFM kullanarak canlı hücrelerin sertliği karakterize etmek için prosedürü göstermektedir. Bir MATLAB rutin kullanarak AFM kalibrasyon süreci, kuvvet eğrisi satın alma ve veri analizi de dahil olmak üzere önemli adımlar gösterilmektedir. Bu yöntemin sınırlamaları da tartışılmıştır.
Introduction
Tek tek hücrelerin kendi çevre hücre dışı matris mekanik özellikleri, özellikle sertlik, (ECM), hücre büyümesi, motilite, bölünmesi, farklılaşma ve doku homeostazında de dahil olmak üzere birçok biyolojik süreçleri için kritiktir. 1 Bu hücre mekanik sertliği esas olarak kararlı olduğu kanıtlanmıştır Aktin ve arafilamentlerin in vitro şebekelerinde üzerinde mekanik testlerden iskeleti, aktin ve ara filamentler ve onlarla ilişkili diğer proteinlerden, özellikle ağ. 2 Sonuç hücre mekanik iskelet yapısı ve ön-stres büyük ölçüde bağlı olduğunu düşündürmektedir hücre iskeleti. canlı hücrelerin 3-5 Sertlik sonra iskelet yapısı 6, miyozin aktivite 7 ve diğer birçok hücresel süreçleri değerlendirmek için bir dizin olarak kabul edilir. Daha da önemlisi, hücre mekanik özelliklerinde değişiklikler de genellikle yakından ilişkili olduğu bulunmuşturtümör oluşumu ve metastaz gibi çeşitli hastalık koşulları ile ated 8-10 İzleme canlı hücrelerin mekanik sertliği dolayısıyla hücre fizyolojisi izlemek için yeni bir yol sağlayabilir,. tespit etmek ve hastalıkları 8 teşhis etmek,. ve ilaç tedavilerinin etkinliğini değerlendirmek için 11 , 12
Parçacık izleme microrheology, 13-16 manyetik büküm sitometri, 17 mikropipet aspirasyon 18,19 ve microindentation 20-22 dahil olmak üzere birden çok yöntem hücrelerin esnekliğini ölçmek için geliştirilmiştir. Parçacık izleme microrheology hücre iskeleti içindeki hücreler ya da indirgeme işaretleri enjekte mikrondan küçük floresan parçacıkların birinin termal vibrasyonlar izler. Hücreler 23 elastik ve yapışkan özelliklerini salınım-kayıp teoremi kullanılarak ölçülen partikül değiştirmeler hesaplanır. 14,23 Bu yöntem sağlar: yerel eş zamanlı ölçümleriniBir hücrede farklı yerlerde yüksek uzaysal çözünürlüğü ile mekanik özellikleri. Bununla birlikte, parçacıkların hücre içine floresan enjekte hücresel işlevde değişikliği, hücre iskeletinin yapısı, ve bu nedenle hücre mekanik yol açabilir. Mikropipet aspirasyon yöntemi pipet içine hücre zarı küçük bir parça emmek için 1 ila 5 mikron arasında değişen çaplı bir mikropipet negatif basınç uygular. Hücre sertliği uygulanan negatif basınç, hücre membranı ve deformasyonu. 18 Bu yöntem ile hesaplanır, ancak, hücre boyunca sertliğinin heterojen dağılımı tespit edemez. Manyetik büküm sitometri (MTC) hücre zarı bağlı süper paramanyetik boncuk tork üretmek için manyetik alan uygulanır. 17 Hücre sertliği uygulanan tork ve hücre zarının büküm deformasyon arasındaki ilişki bu yöntemde elde edilir. Bu MTC yöntemde manyetik boncuk yerini kontrol etmek zordur, ve aynı zamanda bir challengiyüksek çözünürlüklü büküm deformasyon karakterize etmek ng. Microindentation hücre içine yumruk iyi tanımlanmış geometri ile bir delici geçerlidir. Girinti kuvvet ve hücrelerde ortaya çıkan girinti genellikle Hertz modelinin tahmin izleyin. Hücre Young modülü Hertz modeli onları takarak kuvvet girinti eğrileri hesaplanabilir. Bu yöntem yaygın olarak temas noktası belirleme, Hertz modelin uygulanabilirliği ve fiziksel olarak hücrelere zarar potansiyeline belirsizlik olarak sınırlamalar rağmen doku ve hücrelerin mekanik özelliklerini test etmek için uygulanmıştır. Microindentaion 20 için birçok cihaz arasında, bir atomik kuvvet mikroskobu (AFM), ticari olarak mevcuttur ve yaygın olarak canlı hücreler ve dokuların 21,24-27 mekanik özelliklerini karakterize etmek için uygulanmıştır.
Bu kağıt hücre mekaniği karakterize bir Sığınma MFP3D-Bio AFM kullanarak prosedürü göstermektedir. AFM değil üzerindely hücrelerin yüksek çözünürlüklü topografya sağlar ama aynı zamanda yaygın doku hücrelerinin mekanik özelliklerini karakterize etmek için uygulanmıştır. AFM girinti çalışma prensibi Şekil 1 'de gösterilmiştir. AFM konsol üzerinde birkaç mikrometre hücre yaklaşımlar, hücre ile temas, girintiler hücre konsol sapma önceden seçilmiş bir ayar noktasına ulaşacak şekilde ve uzak hücreden çeker. Şekil 1 'de gösterildiği gibi, bu süreç sırasında dirsekli bükülme konumu bir fonksiyonu olarak kaydedilmektedir. Hücre ile temas etmeden önce, konsol belirgin bir sapma olmadan ortamda hareket eder. Hücre, konsol virajlı ve sapma sinyali artar girinti zaman. Çıkma kendi saptırma hücreye tatbik edilen kuvvet ile orantılıdır, böylece elastik kirişler olarak modellenmiştir. En fazla konsol sapma ayarlayarak, örnek uygulanan kuvvetin maksimum büyüklüğü d önlemek için sınırlıdırhücrelere ermeden. Hücre içine ucu girintiler, hücre sertliği ayıklamak için hertz modele uygundur Şekil 1, c noktadan noktaya b kuvvet eğrisinin kısmı.
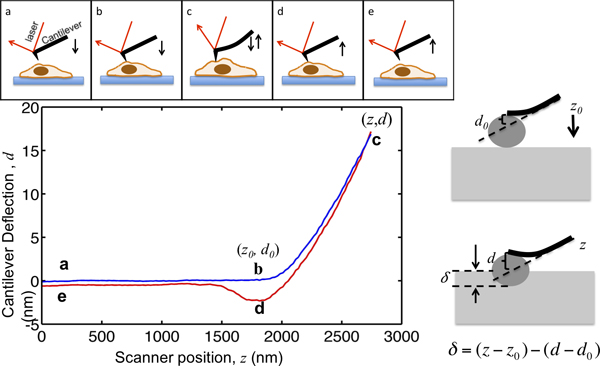
Şekil 1. AFM microindentation ve kuvvet eğrisinin yorumlanması İllüstrasyon. Üst paneli piezo tarayıcı tarafından tahrik AFM konsol hareketini gösterir. Konsol, z ve konsol sapma sinyalini d dikey konumu işlemi sırasında kaydedilir. Konsol noktası, hücrenin üstündeki birkaç mikrometre başlar. Hücre yaklaşırken iken uç hücre ile temas alanına, b ulaşıncaya kadar, örnek girinti δ sıfır olarak kalır. Arsa nokta b koordinatları kritik değerlerdirveri analizi için, (z 0, d 0>) ile gösterilir. B c, hücre içine konsol girintiler konsol sapma hedeflenen maksimum girinti gücü ve sürekli konsol bahar arasındaki oran olarak ayarlanmış bir ayar noktası, ulaşana kadar. Sapma sinyali önceden ayarlanmış maksimum değeri ulaştığında, konsol sonra, hücreden genellikle uç-örnek yapışma nedeniyle aşağıya çekilebilir noktası d, çekilmiş hücre ve döner e onun ilk konuma ayırır edilir. Sağ panel girinti ve kaydedilen z ve d sinyal arasındaki ilişkiyi göstermektedir. Sol alt panelde bulunan yay sabiti m / 0.07N olarak ölçüldüğü bir temsilcisi kuvveti eğrisi, bir konsol en fazla girinti, bir çizimidir fazla girinti kuvvet uygulanır ve böylece 17 nm olarak ayarlanmıştır Örnek 1.2 nN olduğunu. Girinti sırasında önemli yerlerde işaretlenmiştir.
Protocol
Representative Results
Discussion
AFM girinti yöntemi canlı hücrelerin mekanik özelliklerini karakterize etmek için avantajları vardır. Piconewton düzeyinde 32 kuvvetleri ölçebilirsiniz manyetik büküm sitometri ve optik cımbız, daha az hassas olsa, AFM kuvvet aralığı ile karşılaştırılabilir pico-Newton onlarca nano-Newton yüzlerce kadar örnekleri, gelen direnç kuvveti algılayabilir Mikropipet 19 kullanarak hücrelere uygulanabilir. Kuvvet Bu dizi hücre 19 her türlü ölçülebilir deformasyonl…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Yazarlar bu çalışmada kullanılan hücre hatları sağlamak için Pennsylvania Üniversitesi'nden Dr Paul Janmey teşekkür ederim. QW da AFM teknikleri üzerine anlayışlı tartışmalar için JF Byfield ve Evan Anderson kabul.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

