De<em> Xenopus</em> Eicel opengesneden Vaseline Gap voltage-clamp techniek Met fluorometrie
Summary
De opengesneden Vaseline gap benadering wordt gebruikt om lage ruis opnames van ionische en gating stromen van spanningsafhankelijke ionkanalen uitgedrukt in Xenopus oöcyten met een hoge resolutie van snelle kanaal kinetiek verkrijgen. Met kleine wijzigingen, kunnen spanningsklem fluorimetrie worden gekoppeld aan de opengesneden eicel protocol.
Abstract
De opengesneden eicel Vaseline gap (COVG) voltage clamp techniek maakt het mogelijk voor de analyse van elektrofysiologische en kinetische eigenschappen van heterologe ionkanalen in eicellen. Opnames van de opengesneden setup zijn vooral nuttig voor het oplossen van lage magnitude gating stromen, snelle ionenstroom activering en deactivering. De belangrijkste voordelen via twee elektroden spanningsklem (TEVC) techniek omvatten een toename klemsnelheid, verbeterde signaal-ruisverhouding en het vermogen om de intracellulaire en extracellulaire milieu moduleren.
Hier maken we de menselijke cardiale natrium kanaal (HNA V 1.5), uitgedrukt in Xenopus oöcyten, de opengesneden setup en protocol alsook over eventuele wijzigingen die nodig zijn om spanningsklem fluorometrie mogelijkheden toe te voegen aan te tonen.
De eigenschappen van snelle activerende ionkanalen, zoals HNA V 1.5, niet volledig kan worden opgelost in de buurt van kamertemperatuur met behulp TEVC, in which het geheel van de eicel membraan geklemd, waardoor spanningsregeling moeilijk. Echter, in de opengesneden techniek, isolatie van slechts een klein deel van het celmembraan zorgt voor de snelle klemmen die nodig zijn om nauwkeurig registreren snelle kinetiek terwijl het voorkomen kanaal vervallen in verband met patch clamp technieken.
In combinatie met de COVG techniek kinetiek van ionkanalen en elektrofysiologische eigenschappen kunnen verder worden getest door voltage clamp fluorometrie, waar eiwithoudende beweging wordt gevolgd via cysteïneconjugatie van extracellulair toegepaste fluoroforen, insertie van genetisch gecodeerde fluorescente proteïnen, of de opname van onnatuurlijke aminozuren in het gebied van belang 1. Deze extra gegevens levert kinetische informaties spanningsafhankelijke conformationele herschikkingen van het eiwit via veranderingen in de micro-omgeving rond het fluorescent molecuul.
Introduction
Gespecialiseerde spanning klem technieken toestaan dat de opname van de ionische stromen bij een gecontroleerde membraanpotentialen. Wijd gebruikt twee-elektrodespanning klem (TEVC) en patch clamp technieken betrouwbare elektrofysiologische informatie over de eigenschappen van vele ionkanalen. Echter, beide methoden hebben nadelen die het verkrijgen van betrouwbare gegevens voor snelle spanningsafhankelijke natriumkanalen en andere snelle activerende kanalen in membranen zoals die van Xenopus oöcyten voorkomen. De Bezanilla en Stefani laboratoria dus ontwikkelde de opengesneden Vaseline kloof voltage clamp techniek (COVG) voor eicellen 2. De techniek is algemeen toegepast opnemen, Na +, K + en Ca2 + kanalen 3-8.
Tijdens COVG opname wordt een heterologe-eiwit tot expressie brengen eicel membraan verdeeld in drie regio's. De ionische stroom gegevens worden opgetekend uit de topgebied van de eicel alsbad rond het topgebied geklemd om een commando potentieel, dat gemakkelijk en snel kan worden veranderd. Het middengebied waakt tegen lekstromen door klemming dezelfde potentiaal als de bovengebied 9. Het onderste gebied is waar eicel opening (opengesneden) gebeurt door middel van een saponine-oplossing of canule. Chemisch of handmatig openen van het membraan in het bodemgebied controle mogelijk van de interne potentieel, dat wordt vastgeklemd aan de grond en maakt de cel inwendige grenzen aan de onderste kamer oplossing. Perfusie van oplossingen in de onderste kamer kan de eigenschappen van de interne omgeving aan te passen, terwijl oplossing uitwisseling in de bovenste kamer verandert de externe omgeving. 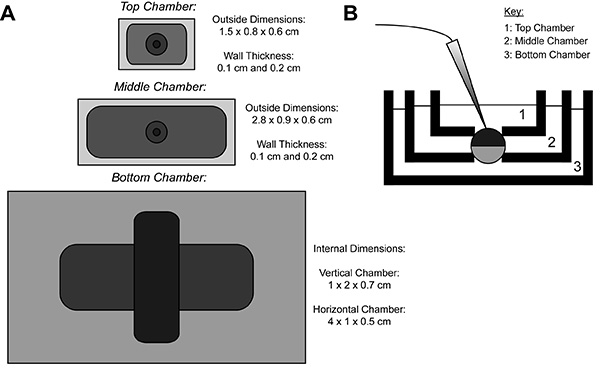
Figuur 1. Eicel opengesneden Voltage-Clamp Bath Installatieblad. (A) Topdown view van de drie baden van elkaar gescheiden. De afmetingen van de kamers voor COVG worden weergegeven op de figuur. (B) Zijaanzicht van de baden setup in het testen positie. Klik hier voor grotere afbeelding .
De voordelen van de COVG techniek zijn lage stroomruis (1 nA 3 kHz), de controle van de ionische samenstelling van het externe medium, de mogelijkheid om de interne media, snelle tijdsresolutie (20-100 usec tijdconstante van verval van het moduleren capaciteit voorbijgaande) en stabiele opnamen gedurende enkele uren 9. De nadelen zijn dat het vereist speciale apparatuur en het is moeilijker uit te voeren vergeleken met electrodes voltage klem (TEVC) 10.
Terwijl de COVG benadering vereist zeer gespecialiseerde apparatuur en ingewikkelde procedurele elementen, kan het mogelijk maken voor de verwerving van waardevollekunnen elektrofysiologische gegevens. Deze gegevens, zoals het poorten stromen met snelle kinetiek en staart stromingen 4, kan worden opgenomen zonder een aantal van de kwesties in verband met andere spanning klem protocollen waaronder kanaal vervallen. Kleine aanpassingen aan de COVG setup kunnen zorgen voor het gebruik van de temperatuurregelaars en spanningsklem fluorometrie (VCF). De opname van spanningsklem fluorometrie elementen binnen de COVG montage kan data output te vergroten door het verlenen van de mogelijkheid om eiwit conformationele veranderingen te monitoren, terwijl het gelijktijdig opnemen van de huidige 11-13.
Protocol
Representative Results
Discussion
De opengesneden eicel Vaseline kloof voltage clamp techniek zorgt voor een snelle oplossing van gegevens, lage ruis, meer controle over interne oplossing en externe oplossing compositie en stabiele opnames over relatief lange protocollen 19. Deze voordelen stellen deze techniek naast de standaard twee-elektrode voltage clamp en patch clamp technieken. Hoewel gespecialiseerde apparatuur nodig is en het protocol is relatief moeilijk, heel weinig problemen optreden zodra het systeem is geoptimaliseerd. Dit maakt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Alle leden van de Washington University in St. Louis Cardiac Molecular Engineering Lab. Een Burroughs Welkom Fonds Career Award op het Wetenschappelijk Interface – 1010299 (JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

