Den<em> Xenopus</em> Oocytter Cut-open vaselin Gap Voltage-klemme teknikk med fluorometri
Summary
Cut-open vaselin gap tilnærming blir brukt for å oppnå lavt støynivå innspillinger av ioniske og gating strømmer fra spenningsavhengige ionekanaler uttrykt i Xenopus oocytter med høy oppløsning på raske kanalkinetikk. Med mindre modifikasjoner, kan spennings-klemme fluorometri sammenkoples med cut-åpen oocytten protokoll.
Abstract
Cut-open eggcelle vaselin gap (COVG) spenning klemme teknikken gjør det mulig for analyse av elektrofysiologiske og kinetiske egenskaper av heterologe ionekanaler i ubefruktede egg. Opptak fra cut-åpen oppsett er spesielt nyttig for å løse lave magnitude gating strømninger, rask ionisk nåværende aktivering og deaktivering. De viktigste fordeler i forhold til de to-elektrodespenningsklemme (TEVC) teknikk inkluderer økt klemme hastighet, forbedret signal-til-støy-forhold, og evnen til å modulere den intracellulære og ekstracellulære miljø.
Her benytter vi den menneskelige hjertenatriumkanalen (HNA V 1.5), uttrykt i Xenopus oocytter, for å demonstrere cut-åpen oppsett og protokoll samt endringene som er nødvendige for å legge spenning klemme fluorometri evne.
Egenskapene til raske aktiverings ionekanaler, som for eksempel HNA V 1.5, ikke fullt ut kan løses nær romtemperatur ved hjelp TEVC, i hh helheten av oocytten membranen er fastklemt, slik at spenningskontroll vanskeligere. Imidlertid, i cut-åpen teknikk, isolering av bare en liten del av cellemembranen tillater hurtig fastspenning nødvendig for å nøyaktig registrere hurtige kinetikk, mens den forhindrer kanal nedslitt forbundet med patch clamp-teknikker.
I forbindelse med COVG teknikk, ionekanal-kinetikk og elektrofysiologiske egenskaper kan bli ytterligere analysert ved hjelp av spennings-klemme fluorometri, hvor protein bevegelsen spores via cystein konjugering av ekstracellulært anvendt fluoroforer, innsetting av genetisk kodede fluorescerende proteiner, eller inkorporering av unaturlige aminosyrer inn i regionen av interesse en. Denne tilleggsdata gir kinetisk informasjon om spenningsavhengige konformasjonsforandringer rearrangements av proteinet gjennom endringer i mikromiljøet som omgir det fluorescerende molekyl.
Introduction
Spesialiserte spenningsklemmeteknikk tillater opptak av ioniske strømmer ved kontrollerte membranpotensialer. Mye brukt to-elektrode spenningsklemmen (TEVC) og patch clamp teknikker gir pålitelig elektrofysiologisk informasjon om egenskapene til mange ionekanaler. Men begge disse metodene har ulemper som hindrer anskaffelse av pålitelige data for rask spenningsstyrte natriumkanaler og andre fast aktiverings kanaler i membraner som for eksempel de av Xenopus oocytter. De Bezanilla og Stefani laboratorier følgelig utviklet cut-åpen vaselin gap spenning klemme teknikk (COVG) for egg 2. Teknikken har blitt brukt mye til å spille inn, Na +, K +, og Ca 2 + kanaler 3-8.
Under COVG opptak, er en heterologt protein-uttrykke eggcelle membran delt inn i tre regioner. Den ioniske strøm av data blir tatt opp fra den øverste regionen av oocytten sombad som omgir den øverste region er festet til en lede potensial, som kan enkelt og raskt skiftes. De midtre region beskytter mot lekkasjestrøm ved å bli spent fast til samme potensial som den øverste regionen ni. Den nedre område er der oocytt åpning (cut-åpen) skjer ved hjelp av et saponin løsning eller en kanyle. Kjemiske eller manuell åpning av membranen i det nedre område tillater kontroll av den indre potensial, som er festet til bakken, og gjør cellen innvendig sammenhengende med det nedre kammer løsning. Perfusjon av løsninger inn i det nedre kammer kan justere egenskapene til det indre miljø, mens oppløsningen veksling i den øverste kammeret endrer de eksterne omgivelsene. 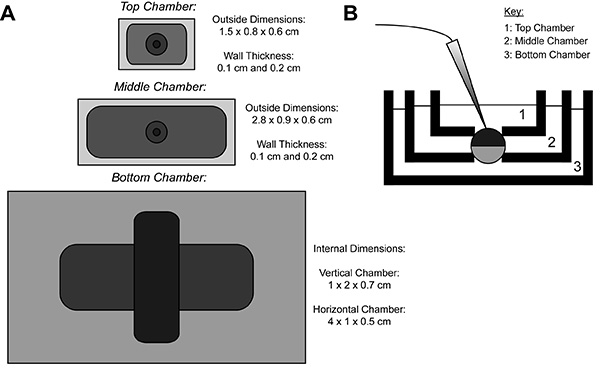
Figur 1. Eggcelle Cut-Open Voltage-Clamp Bath Setup Diagram. (A) Topned-visning av de tre bad atskilt fra hverandre. Dimensjonene av kamrene for COVG er vist på figuren. (B) Sett fra siden av badstuer oppsett i testing posisjon. Klikk her for å se større bilde .
Fordelene med COVG teknikk omfatter lav strømstøy (1 nA på 3 kHz), kontroll av den ioniske sammensetning av eksterne medier, evnen til å modulere den interne mediet, fast tidsoppløsning (20-100 usekunder tidskonstanten for nedbrytning av kapasitet transient), og stabile opptak i flere timer 9. Ulempene er at det krever spesialutstyr, og det er mer vanskelig å utføre sammenlignet med to-elektrodespenningsklem (TEVC) 10.
Mens COVG tilnærming krever høyt spesialisert utstyr og intrikate prosessuelle elementer, kan det gi rom for kjøp av verdifulledyktige elektrofysiologiske data. Denne informasjonen, som for eksempel gating strømninger med raske kinetikk og hale strømninger 4, kan tas opp uten noen av problemene forbundet med andre spenningsklem protokoller inkludert kanal nedslitt. Mindre modifikasjoner til COVG oppsett kan tillate bruk av temperaturkontrollere og spenning klemme fluorometri (VCF). Inkludering av spenning klemme fluorometri elementer innen COVG forsamlingen kan øke datautgang ved å konferere muligheten til å overvåke protein konformasjonsendringer samtidig opptak nåværende 11-13.
Protocol
Representative Results
Discussion
The cut-open oocyte Vaseline gap voltage clamp technique allows for rapid resolution of data, low noise, increased control over internal solution and external solution composition, and stable recordings over relatively long protocols19. These advantages set this technique apart from the standard two-electrode voltage clamp and patch clamp techniques. Although specialized equipment is required and the protocol is relatively difficult, very few issues occur once the system has been optimized. This allows for rep…
Divulgations
The authors have nothing to disclose.
Acknowledgements
All the members of the Washington University in St. Louis Cardiac Molecular Engineering Lab. A Burroughs Welcome Fund Career Award at the Scientific Interface – 1010299 (to J.S.).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

