Il<em> Xenopus</em> Ovociti Cut-open vaselina Gap Tecnica Voltage-clamp Con fluorometria
Summary
L'approccio gap vaselina cut-aperto viene utilizzato per ottenere bassi registrazioni sonore di correnti ioniche e gating di canali ionici voltaggio-dipendenti espressi in oociti di Xenopus con alta risoluzione di canale cinetiche veloci. Con piccola modifica, morsetto di tensione fluorometria può essere accoppiato al protocollo ovocita cut-open.
Abstract
L'ovocita vaselina gap cut-open (COVG) clamp di tensione permette l'analisi delle proprietà elettrofisiologiche e cinetiche dei canali ionici eterologa in oociti. Registrazioni dalla configurazione cut-open sono particolarmente utili per risolvere basse correnti di magnitudo gating, rapida attivazione corrente ionica e disattivazione. I principali vantaggi rispetto al morsetto di tensione a due elettrodi (TEVC) tecnica includono maggiore velocità morsetto, miglior rapporto segnale-rumore, e la capacità di modulare la intracellulare ed extracellulare.
Qui, impieghiamo canale del sodio cardiaco umano (HNA 1,5 V), espresso in oociti di Xenopus, per dimostrare la configurazione e protocollo cut-open nonché modifiche necessarie per aggiungere capacità fluorometria morsetto di tensione.
Le proprietà dei canali ionici veloci attivanti, come HNA 1,5 V, non possono essere completamente risolti a temperatura ambiente usando TEVC, in which la totalità della membrana dell'oocita è serrato, rendendo difficile il controllo della tensione. Tuttavia, nella tecnica cut-aperto, separazione di solo una piccola porzione della membrana cellulare consente il bloccaggio rapido necessaria per registrare accuratamente cinetica veloce evitando canale run-down associato a tecniche di patch clamp.
In concomitanza con la tecnica COVG, cinetica del canale ionico e proprietà elettrofisiologiche possono essere ulteriormente analizzati mediante morsetto fluorometria tensione, in cui il movimento proteina viene monitorato tramite cisteina coniugazione di fluorofori applicate extracellulare, inserimento di proteine fluorescenti geneticamente codificati, o l'incorporazione di amminoacidi non naturali nella regione di interesse 1. Questi dati aggiuntivi produce informazioni cinetiche su voltaggio-dipendenti riarrangiamenti conformazionali della proteina attraverso cambiamenti nel microambiente circostante la molecola fluorescente.
Introduction
Tecniche tensione di serraggio specializzati permettono la registrazione di correnti ioniche a potenziali di membrana controllate. Ampiamente usato voltage clamp a due elettrodi (TEVC) e tecniche di patch clamp forniscono informazioni elettrofisiologiche attendibili sulle proprietà di molti canali ionici. Tuttavia, entrambi questi metodi hanno inconvenienti che impediscono l'acquisizione di dati affidabili per i canali del sodio voltaggio-dipendenti veloci e altri canali attivanti veloce nelle membrane come quelle di ovociti di Xenopus. I laboratori Bezanilla e Stefani quindi sviluppato la tecnica del clamp di tensione gap vaselina cut-open (COVG) per ovociti 2. La tecnica è stata ampiamente applicata per registrare, Na +, K + e Ca 2 + canali 3-8.
Durante la registrazione COVG, una membrana dell'oocita-proteina eterologa esprimere è diviso in tre regioni. I dati corrente ionica viene registrata dalla regione superiore del ovocita comebagno circonda la regione superiore è fissata ad un potenziale di comando, che può essere cambiata facilmente e rapidamente. Le guardie regione del Medio contro le correnti di dispersione di essere bloccato allo stesso potenziale come la regione top 9. La regione inferiore è dove apertura ovocita (cut-open) avviene mediante l'utilizzo di una soluzione di saponina o una cannula. Chimica o apertura manuale della membrana nella regione inferiore permette il controllo del potenziale interno, che viene fissato al terreno, e rende l'interno della cellula contigua con la soluzione camera inferiore. Perfusione di soluzioni nella camera inferiore può regolare le proprietà dell'ambiente interno, mentre lo scambio di soluzione nella camera superiore altera l'ambiente esterno. 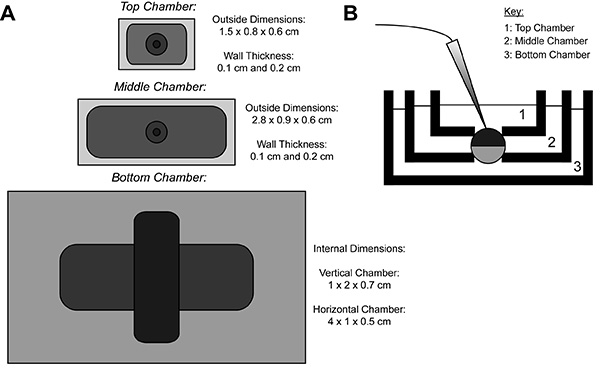
Figura 1. Ovociti Cut-Open Voltage-Clamp Bath Diagramma di installazione. (A) Topdown vista di tre bagni separati l'uno dall'altro. Le dimensioni delle camere per COVG vengono visualizzati sulla figura. (B) Vista laterale della configurazione bagni in posizione di prova. Clicca qui per vedere l'immagine ingrandita .
I vantaggi della tecnica COVG includono basso rumore corrente (1 nA a 3 kHz), il controllo della composizione ionica del supporto esterno, la capacità di modulare il supporto interno, risoluzione temporale veloce (20-100 costante msec tempo di decadimento della capacità transitorio), e le registrazioni stabili per diverse ore 9. Gli svantaggi sono che richiede attrezzature specializzate ed è più difficile da eseguire rispetto a due serraggio tensione elettrodo (TEVC) 10.
Mentre l'approccio COVG richiede attrezzature altamente specializzate e elementi procedurali complessi, può consentire l'acquisizione di Valudati elettrofisiologici grado. Questi dati, come gating correnti con cinetica veloce e correnti di coda 4, può essere registrata senza alcuni dei problemi associati con altri protocolli tensione di chiusura comprese canale run-down. Piccole modifiche alla configurazione COVG possono consentire l'uso di regolatori di temperatura e morsetto di tensione fluorometria (VCF). L'inclusione di tensione morsetto elementi fluorometria all'interno dell'assembly COVG può aumentare output di dati conferendo la possibilità di monitorare cambiamenti conformazionali proteiche e contemporaneamente la registrazione corrente 11-13.
Protocol
Representative Results
Discussion
L'ovocita vaselina tensione gap clamp cut-open consente una rapida risoluzione dei dati, a basso rumore, aumentato il controllo sulla soluzione interna e la composizione soluzione esterna, e registrazioni stabili nel relativamente lunghi protocolli 19. Questi vantaggi impostate questa tecnica a parte il voltage clamp a due elettrodi standard e le tecniche di patch clamp. Sebbene attrezzature specializzate è necessaria e il protocollo è relativamente difficile, molto pochi problemi si verificano quando i…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Tutti i membri della Washington University di St. Louis Cardiac molecolare Engineering Lab. Un Burroughs Welcome Fondo Premio alla Carriera al Interface scientifico – 1010299 (JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

