O<em> Xenopus</em> Oocyte Cut-aberto vaselina Gap Técnica Voltage-clamp Com Fluorometria
Summary
A abordagem lacuna vaselina cut-aberto é usado para obter baixos gravações de ruídos de correntes iônicas e gating de canais iônicos dependentes de voltagem expressos em oócitos de Xenopus com alta resolução de cinética de canais rápidos. Com modificações menores, fixador de tensão fluorometria pode ser acoplado com o protocolo do oócito corte aberto.
Abstract
A vaselina oócito lacuna cut-aberto (COVG) técnica braçadeira de tensão permite a análise das propriedades eletrofisiológicas e cinéticos de canais iônicos heterólogas em oócitos. Gravações do setup cut-aberto são particularmente úteis para a resolução de correntes de baixa magnitude gating, rápida ativação corrente iônica e desativação. As principais vantagens sobre a tensão de dois eléctrodos de aperto (TEVC) técnica incluem o aumento da velocidade de fixação, uma melhor relação sinal-ruído, e a capacidade de modular o intracelular e meio extracelular.
Aqui, nós empregamos o canal de sódio cardíaco humano (HNA V 1.5), expressa em oócitos de Xenopus, para demonstrar a configuração cut-aberto e protocolo, bem como as modificações que são necessárias para adicionar capacidade de fluorometria braçadeira de tensão.
As propriedades dos canais iônicos de ativação rápida, como HNA V 1.5, não pode ser totalmente resolvido em temperatura ambiente usando TEVC, em which, a totalidade da membrana do oócito é apertado, tornando difícil o controlo da tensão. No entanto, na técnica de corte-aberto, o isolamento de apenas uma pequena porção da membrana celular permite a fixação rápida necessária para registar com precisão cinética rápida evitando canal degradado associado com técnicas de fixação de membranas.
Em conjunção com a técnica COVG, cinética do canal de iões e propriedades electrofisiológicas pode ser ainda analisada utilizando fluorimetria fixador de tensão, onde o movimento é controlado por meio da proteína de cisteína de conjugação de fluoróforos extracelularmente aplicadas, a inserção de proteínas fluorescentes codificados geneticamente, ou a incorporação de aminoácidos não naturais na região de interesse 1. Esta informação adicional produz informação cinética sobre rearranjos conformacionais dependentes de voltagem da proteína através de alterações no microambiente em torno da molécula fluorescente.
Introduction
Técnicas de fixação de tensão especializados permitir a gravação de correntes iônicas de potenciais de membrana controladas. Amplamente utilizado braçadeira de tensão de dois eletrodos (TEVC) e técnicas de patch clamp fornecer informações eletrofisiológico confiável sobre as propriedades de muitos canais iônicos. No entanto, ambos os métodos têm desvantagens que impedem a obtenção de dados confiáveis para os canais de sódio dependentes da voltagem rápidos e outros canais de ativação rápida nas membranas, como as de oócitos de Xenopus. Os laboratórios Bezanilla e Stefani, consequentemente, desenvolveu a técnica lacuna vaselina braçadeira de tensão cut-aberto (COVG) para ovócitos 2. A técnica tem sido amplamente aplicada para gravar, Na +, K +, Ca 2 + e canais de 3-8.
Durante a gravação COVG, uma membrana do oócito expressando a proteína heteróloga é dividido em três regiões. Os dados de corrente iônica é gravado a partir da região superior do oócito como obanho em torno da região superior é presa a um potencial de comando, que pode ser fácil e rapidamente mudado. Os guardas região meio contra correntes de fuga ao ser fixada ao mesmo potencial que a região superior 9. A região inferior é onde a abertura do oócito (cut-open) ocorre através do uso de uma solução de saponina ou uma cânula. Química ou a abertura manual da membrana na região do fundo permite um controlo do potencial interno, que está fixada ao solo, e torna a célula contígua com a solução interior da câmara inferior. Perfusão de soluções para a câmara inferior pode ajustar as propriedades do ambiente interno, enquanto troca da solução na câmara de topo altera o ambiente externo. 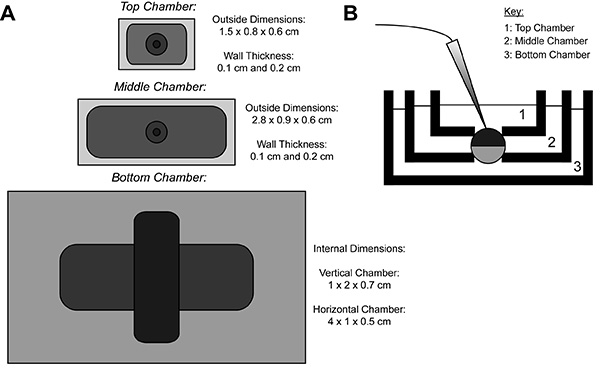
Figura 1. Oocyte Cut-Open Voltage-Clamp Bath Setup Diagram. (A) Topabaixo da vista dos três banhos separados um do outro. As dimensões das câmaras para COVG são apresentados na figura. (B) Vista lateral da configuração banhos em posição de teste. Clique aqui para ver a imagem ampliada .
As vantagens da técnica COVG incluem baixo nível de ruído atual (1 nA a 3 kHz), o controle da composição iônica dos meios externos, a capacidade de modular os meios de comunicação interna, resolução de tempo rápido (20-100 constante ms de tempo de decaimento do capacidade transitória), e gravações estáveis por várias horas 9. As desvantagens são que requer equipamento especializado e é mais difícil de realizar em comparação com dois de fixação de tensão de eléctrodo (TEVC) 10.
Embora a abordagem COVG requer equipamentos altamente especializados e elementos processuais complexas, pode permitir a aquisição de valiosodados eletrofisiológicos capazes. Estes dados, como gating correntes com cinética rápida e correntes cauda 4, podem ser gravadas sem alguns dos problemas associados com outros protocolos de fixação de tensão, incluindo canal degradado. Pequenas modificações na configuração COVG pode permitir o uso de controladores de temperatura e fluorometria braçadeira de tensão (VCF). A inclusão de elementos de fluorometria braçadeira de tensão dentro da montagem COVG pode aumentar a saída de dados, conferindo a capacidade de monitorar mudanças conformacionais de proteínas e ao mesmo tempo de gravação atual 11-13.
Protocol
Representative Results
Discussion
A vaselina oócito tensão lacuna técnica braçadeira cut-aberto permite a resolução rápida de dados, baixo ruído, maior controle sobre a solução interna e composição da solução externa e gravações estáveis através de protocolos relativamente longos 19. Estas vantagens definir esta técnica além de o grampo de voltagem de dois eléctrodos padrão e técnicas de fixação de membranas. Apesar de equipamento especializado é necessária e que o protocolo é relativamente difícil, muito po…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Todos os membros da Universidade de Washington em St. Louis Cardiac Molecular Laboratório de Engenharia. A Burroughs Bem-vindo Fundo Prémio Carreira na Interface Científica – 1010299 (para JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

