인간의 신경의 집계의 cGMP-해당 확장 방법은 줄기 및 전구 세포는 다 능성 줄기 세포 또는 태아 뇌 조직에서 파생 된
Summary
이 프로토콜은 단일 세포 현탁액 분해없이 구형 신경 줄기 및 전구 세포 응집체의 확장을 허용 신규 기계적 자르고 방법을 설명한다. 세포 / 세포의 접촉을 유지하는 것은 40 구절에 대한 신속하고 안정적인 성장을 할 수 있습니다.
Abstract
실험 연구와 임상 시험을위한 단일 시료로부터 세포의 큰 숫자를 축적하는 셀 확장 기술은 크게 줄기 세포 사회를 유익 것이다. 현재의 많은 확장 방법은 힘들고 비용이 많이 드는, 완전한 분리를 포함하는 여러 줄기 및 전구 세포 유형의 분화 또는 초기 노화를 받아야하는 원인이 될 수 있습니다. 이러한 문제를 극복하기 위해, 우리는 간단하고 저렴하다 "마"라 자동화 기계류 계대 방법을 개발했다. 이 기술은 단일 세포로 화학 물질 또는 효소 분해를 방지하고 대신 상수 세포 / 세포 접촉을 유지 정지, 회전 타원체 문화의 대규모 확장 할 수 있습니다. 초핑 방법은 주로 태아 뇌 유래 신경 전구 세포 또는 neurosphere를 위해 사용되었으며, 최근 배아 및 유도 된 다 능성 줄기 세포 유래의 신경 줄기 세포를 사용하기 위해 발행되었다. 프로 시저 involv에스 조직 문화 배양 접시에 neurosphere를 파종 이후에 효과적으로 수동으로 기계적으로 각 영역을 해리의 지루한 과정을 자동화 세포를 통해 날카로운, 멸균 블레이드를 전달합니다. 문화의 세포를 일시 중단하면 유리한 표면적 – 부피 비율을 제공한다; 500,000 이상의 세포는 직경이 0.5 mm 미만의 단일 neurosphere 내 성장시킬 수있는. 한 T175 플라스크에서 50 백만 셀은 1500 만 자기편 문화에 비해 서스펜션 문화에서 성장할 수 있습니다. 중요한 것은, 마 절차는 임상 수준의 세포 제품의 대량 수량의 생산을 허용, 현재 좋은 제조 연습 (cGMP의)에서 사용되어왔다.
Introduction
단층 1-3 또는 집계 neurosphere를 4-7 중 하나로 문화에 쥐 신경 줄기 세포 확장의 긴 역사가있다. 또, 현상 중추 신경계 8-17의 다양한 영역들로부터 격리 된 인간 신경 전구 세포 (hNPCs)는 시험 관내에서 확장되었다. 이 세포는 이중 강력한, 성상 세포 및 신경 세포 모두로 분화 할 수 있으며 신경 발달 (18, 19)과 질병 메커니즘 (20, 21)를 연구에 매우 유용한 도구가되고있다. hNPCs도 통합, 생존 및 기능 효과 22-24 다양한 수준의 중추 신경계 질환의 다양한 동물 모델에 이식되었다.
종종 표피 성장 인자 (EGF) 및 / 또는 섬유 아세포 성장 인자 -2 (FGF-2) 25 ~ 28 – – 및 접착 29 세 모두 전통적 설치류 또는 인간 태아 유래의 NPC가 성장 인자에 노출되어차원 타원체 시스템은 일반적으로 단일 세포 현탁액 30-34로 효소 적 분해를 사용하여 계대된다. 연구 또는 임상 사용을위한 세포를 확장하는 표준 방법은 쉬운 조작에 의한 부착 단층과 같다. 그러나, 우리는 효소 또는 화학 솔루션 계대 단층과 neurosphere hNPCs 초기 노화 35의 결과 것으로 나타났습니다. 또한, 효소 분해는 배아 줄기 세포 36-38 시연 데이터를 기반으로 차별화와 핵형 이상 수준 증가의 원인이 될 수 있습니다. 계대의 hNPCs의 표준 방법은 현재 우수 제조 단계로 1 임상 시험 (세포에게 주식, Neuralstem 주식 줄기) 갈 (의 cGMP) 수준의 제품을 생산하고 있지만,이 방법은 제한, 세포의 증폭 만 몇 라운드를 허용하는 잠재력을 은행.
분명, 많은 연구 실험 및 향후 임상 시험 할 수있는 기능 혜택을 누릴 수대규모 성장 및 세포 은행을 허락 대량 지연된 노화와 세포를 전파. 이러한 요구를 해결하기 위해, 우리는 세포 간 접촉을 유지하기 위해 작은 클러스터로 그들을 "마"의 소설 기계적으로 계대 손상을 neurospheres의 자동화 된 방법을 개발했다. 이 방법은 크게 다른 3D 생물 반응기 배양 방법 (40)으로 된 것과 같이 그들의 수명 (39) 및 현탁 배양은, 단층 배양에 비해 인큐베이터 공간을보다 효율적으로 사용할 수있게 증가 하였다. 제공된 마 프로토콜은 통로 (10), 표준 계대 방법을 사용하여 가능성 위업보다 한 태아의 샘플에서 대형 은행의 생산을 할 수 있습니다. 계대의 hNPCs이 방법은 틀에 얽매이지 않는 동안, 인기가 증가하고 있으며, 최근에는 이러한 인간의 배아와 유도 만능 줄기 세포에서 파생 된 신경 줄기 세포 등 다른 세포 유형, V IN 등 다양한 애플리케이션을위한 대규모 확장을 가능으로 출판되었다나이트로 질환 모델링 41-46. 중요한 것은,의 cGMP 급 hNPC 세포 은행은 이미 기술이 미래의 임상 응용으로 적용 할 수 있다는 것을 보여 마 방법으로 생산되고 있습니다.
Protocol
Representative Results
Discussion
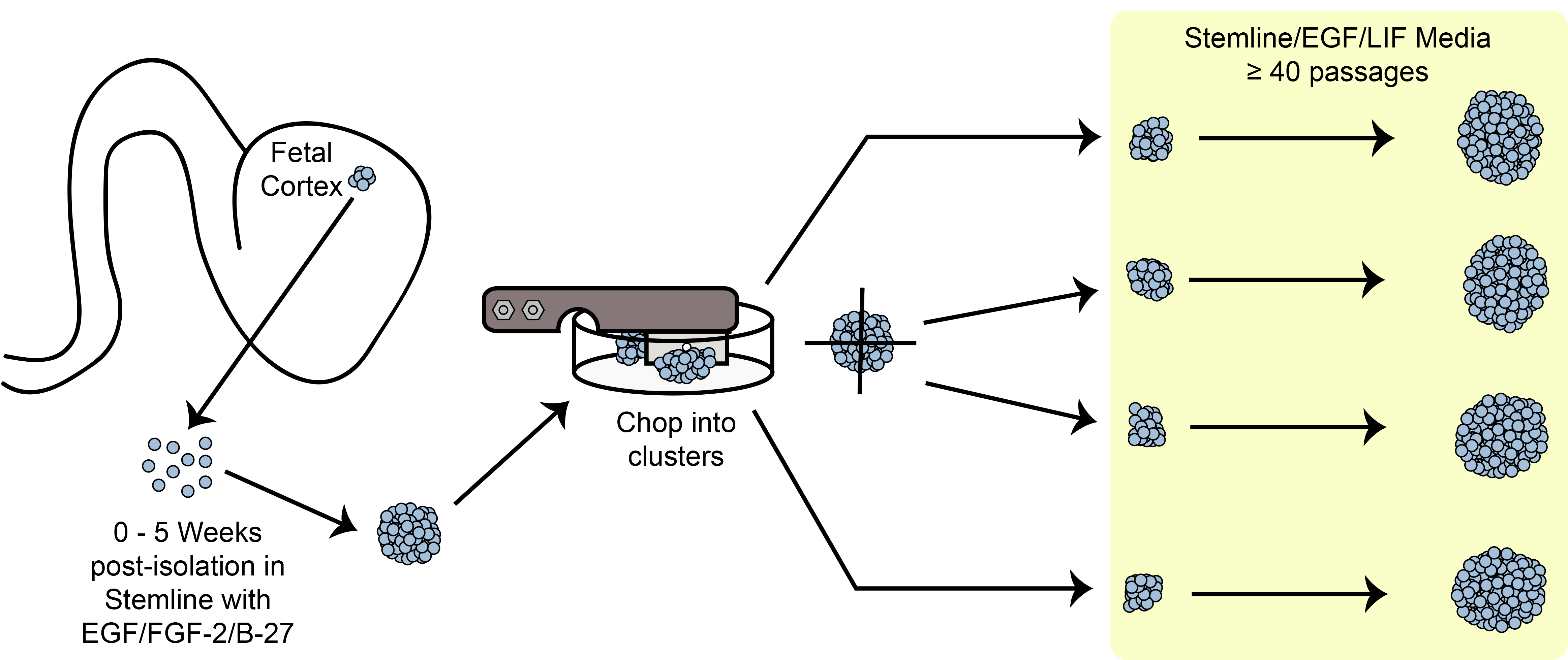
그림 6. 마 회로도. 기계적 마 방법을 사용하여 문화 구형 줄기 / 전구 세포를 확장.
중요한 단계
마 팽창 패러다임의 개요. hNPC 구면 사이즈을 neurospheres 계대 전에 관찰하는 중요한 기준 중 하나가도 6에 도시된다. ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
우리는 중요한 검토 및 본 보고서의 편집을 위해 박사 Soshana Svendsen은 감사합니다. 이 작품은 NIH / NINDS 1U24NS078370-01 및 CIRM DR2A-05320에 의해 기여했다.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neurosciences. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

