שיטת הרחבת cGMP-ישימה עבור מצרפים של עצבי אנושי ותאים שמקורם בתאי גזע pluripotent או רקמת מוח עוברית
Summary
פרוטוקול זה מתאר שיטת חיתוך מכאנית רומן המאפשרת ההתרחבות של אגרגטים גזע ותאים אב עצביים כדוריים ללא ניתוק להשעית תא בודד. שמירה על קשר תא / תא מאפשרת צמיחה מהירה ויציבה במשך 40 מעברים.
Abstract
טכניקת הרחבת תא לצבור מספר גדול של תאים מדגימה אחת עבור ניסויי מחקר וניסויים קליניים תרוויח הקהילה בתאי גזע באופן משמעותי. שיטות הרחבה הנוכחיות רבות מייגע ויקרות, ואלה הקשורים ניתוק מוחלט עלולים לגרום לכמה סוגי גזע ותאים ובתאים לעבור התמיינות או הזדקנות מוקדמת. כדי להתגבר על בעיות אלה, פיתחנו שיטת passaging מכאנית אוטומטית המכונה "קיצוץ" כי הוא פשוט ולא יקר. טכניקה זו מונעת ניתוק כימי או אנזימטי לתאים בודדים, ובמקום זאת מאפשרת להרחבה בקנה מידה גדולה של תרבויות מושעים, אליפטית, כי לשמור על קשר עם תא / תא קבוע. שיטת הקיצוץ יש בעיקר נעשתה שימוש בתאים עובריים שמקורם במוח עצבי אב או neurospheres, ולאחרונה יצאה לאור לשימוש בתאי גזע עצביים שמקורם בתאי גזע pluripotent עובריים ומושרים. Involv ההליךes זריעת neurospheres על גבי צלחת פטרי תרבית רקמה ולאחר מכן עובר להב חד, סטרילי דרך תאי יעילות אוטומציה של התהליך המייגע של ידני מכאני מתנער בכל תחום. השעיית תאים בתרבית מספקת יחס שטח לנפח חיובי פני השטח; כפי שניתן גדלו מעל 500,000 תאים בתוך neurosphere אחד של פחות מ 0.5 מ"מ קוטר. בבקבוק T175 אחד, מעל 50 מיליון תאים יכולים לגדול בתרבויות השעיה לעומת רק 15 מ'בתרבויות חסיד. חשוב מכך, הליך הקיצוץ נעשה שימוש בפרקטיקת ייצור טוב הנוכחית (cGMP), המאפשר ייצור כמות המוני של מוצרי תא כיתה קלינית.
Introduction
יש היסטוריה של הרחבת תאי גזע עצביים מכרסמים בתרבות כמו גם monolayer 1-3 או 4-7 neurospheres המצרפי ארוכה. בנוסף, תאים אנושיים ותאים עצביים (hNPCs) מבודדים מאזורים השונים של מערכת העצבים המרכזית מתפתחת 8-17 הורחבו במבחנה. תאים אלה הם דו עוצמה, מסוגל להבדיל לשני האסטרוציטים ונוירונים והיה כלי שימושי מאוד בלימוד התפתחות עצבית 18,19 ו20,21 מנגנון מחלה. hNPCs גם הושתל לתוך מודלים של בעלי חיים רבים ושונים של מחלות מערכת עצבים מרכזיות עם רמות משתנות של אינטגרציה, הישרדות והשפעות פונקציונליות 22-24.
באופן מסורתי, מכרסם או NPCs נגזר עוברי האנושי חשופים לגורמי גדילה – גורם לעתים קרובות אפידרמיס צמיחה (EGF) ו / או גידול פיברובלסטים גורם-2 (FGF-2) 25-28 – ושניהם 29 חסיד ושלושהמערכות אליפטית ממדיות בדרך כלל passaged באמצעות ניתוק האנזימטית לתוך השעיה תא בודד 30-34. השיטה סטנדרטית להרחבת תאים למחקר או לשימוש קליני היא כmonolayer חסיד בשל מניפולציה קלה. עם זאת, יש לנו הראינו כי hNPCs monolayer passaging וneurosphere עם האנזימטית או תמיסות כימיות הביאה להזדקנות המוקדמת 35. בנוסף, דיסוציאציה האנזימטית עלולה לגרום לרמות מוגברות של מומים בידול וkaryotypic מבוססים על נתונים הפגינו עם תאי גזע עובריים 36-38. למרות שהשיטה סטנדרטית של hNPCs passaging הפיקה בפועל ייצור טוב הנוכחיים מוצרי כיתה (cGMP) שהושקעו בשלב 1 בניסויים קליניים (בתאי גזע Inc, Neuralstem Inc), השיטה מותר רק כמה סיבובים של הגברה תא, המגביל את בנקאי פוטנציאלי.
ברור, ניסויי מחקר גדולים וניסויים קליניים בעתיד יכולים להפיק תועלת מהיכולתלהפיץ תאים בכמויות גדולות ועם הזדקנות מתעכבת כדי לאפשר צמיחה בקנה מידה גדולה ובבנקאות סלולרי. כדי לענות על צורך זה, פיתחנו רומן ודרך אוטומטית של neurospheres שלמות מכאנית passaging ידי "לקצוץ" אותם לקבוצות קטנות כדי לשמור על קשר תא אל התא. בשיטה זו גדלה מאוד תרבות תוחלת החיים 39 והשעיה שלהם מאפשרת שימוש יעיל יותר של שטח חממה בהשוואה לתרבויות monolayer, כפי שניתן לראות בשיטת תרבות bioreactor 3D אלטרנטיבית 40. פרוטוקול הקיצוץ בתנאי מאפשר לייצור של בנקים בקנה מידה גדולה ממדגם העובר אחד גדול יותר ממעבר 10, הישג סביר בשיטות passaging סטנדרטיות. בעוד ששיטה זו לhNPCs passaging היא בלתי שגרתית, הוא גדל ב פופולריות והיה לאחרונה, שפורסם עם סוגי תאים אחרים כגון תאי גזע עצביים שמקורם עוברי אנושי ותאי גזע pluripotent מושרה, המאפשרים התרחבות בקנה מידה גדולה עבור יישומים שונים, כולל בvדוגמנות המחלה itro 41-46. חשוב מכך, בנק תאים בדרגת cGMP hNPC כבר הופק בשיטת החיתוך, הוכחת כי הטכניקה יכולה להיות מיושמת כלפי יישומים קליניים בעתיד.
Protocol
Representative Results
Discussion
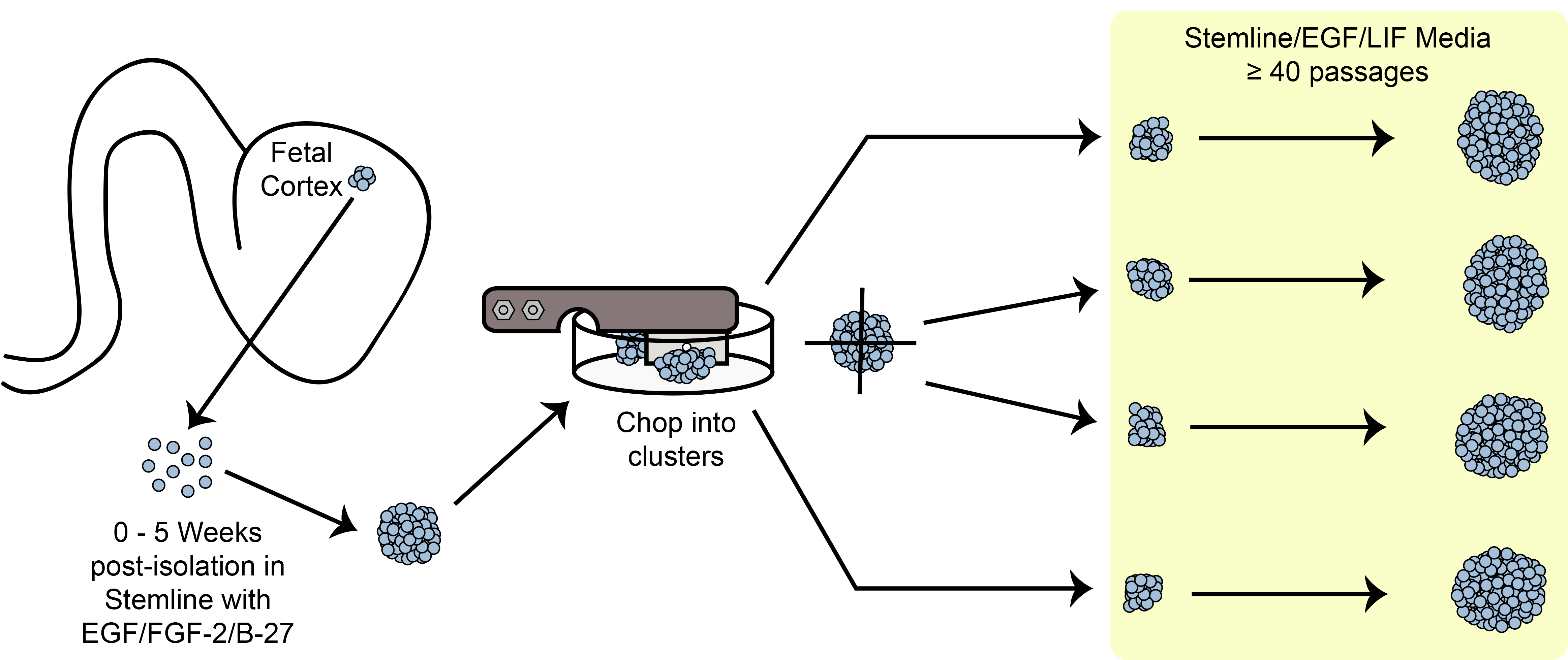
איור 6. חיתוך סכמטי. הרחבת תאי גזע אליפטית / אב בתרבות בשיטת החיתוך המכני.
שלבים קריטיים
סקירה של ה?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
אנו מודים לד"ר Soshana סוונדסן לביקורת ועריכת דוח זה קריטי. עבודה זו תרמה לעל ידי NIH / NINDS 1U24NS078370-01 וCIRM DR2A-05,320.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neurosciences. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

