En cGMP-tillämplig Expansion Metod för aggregat av mänskliga neurala Stem och stamceller härledas från pluripotenta stamceller eller fosterhjärnvävnad
Summary
Detta protokoll beskriver en ny mekanisk hackmetod som tillåter att expansionen av sfäriska neurala stam-och stamfadercellaggregat utan dissociation till en enkelcellsuspension. Att upprätthålla cell / cell kontakt möjliggör snabb och stabil tillväxt i över 40 passager.
Abstract
En utbyggnad cell teknik för att samla ett stort antal celler från en provkropp för forskningsexperiment och kliniska prövningar skulle ha stor nytta av stamcells samhället. Många nuvarande expansionsmetoder är arbetskrävande och kostsamma, och de som involverar fullständig dissociation kan orsaka flera stam-och stamfader celltyper att genomgå differentiering eller tidigt åldrande. För att övervinna dessa problem har vi utvecklat en automatiserad mekanisk aging metod kallad "hackning", som är enkel och billig. Denna teknik undviker kemisk eller enzymatisk dissociation i enskilda celler och i stället möjliggör storskalig utbyggnad av suspenderade, sfäroida kulturer som upprätthåller konstant cell / cell kontakt. Den hack Metoden har främst använts för fetala hjärn-härledda neurala stamceller eller neurosfärer, och har nyligen publicerats för användning med neurala stamceller från foster och inducerade pluripotenta stamceller. Proceduren involverares sådd neurospheres på en vävnadsodling petriskål och därefter passera en skarp, steril blad genom cellerna effektivt automatisera den tråkiga processen att manuellt mekaniskt dissociera varje sfär. Att avbryta celler i odling ger en gynnsam ytarea-till-volymförhållande; som över 500.000 celler kan odlas i en enda neurosfär som är mindre än 0,5 mm i diameter. I en T175 kolv, kan över 50 miljoner celler växa i suspensionskulturer jämfört med endast 15 miljoner i vidhäftande kulturer. Huvudsakligen har det hugga förfarande använts enligt gällande god tillverkningssed (cGMP), som möjliggör massproduktion av cellprodukter klinisk kvalitet kvantitet.
Introduction
Det finns en lång historia av att expandera gnagare neurala stamceller i kultur som antingen en monolager 1-3 eller aggregerade neurospheres 4-7. Vidare har humana neurala stamceller (hNPCs) som isolerats från olika regioner i utvecklings centrala nervsystemet 8-17 expanderats in vitro. Dessa celler är bi-potenta, förmåga att differentiera till både astrocyter och nervceller och har varit ett mycket användbart verktyg för att studera neurala utveckling 18,19 och sjukdomsmekanism 20,21. hNPCs har också transplanterats in i flera olika djurmodeller av centrala nervsystemet med olika nivåer av integration, överlevnad och funktionella effekter 22-24.
Traditionellt är gnagare eller humana fetala härledda NPC exponeras för tillväxtfaktorer – ofta epidermal tillväxtfaktor (EGF) och / eller fibroblasttillväxtfaktor-2 (FGF-2) 25 till 28 – och både vidhäftande 29 och tre-Dimension sfäroida system typiskt passe använder enzymatisk dissociation i en encelliga suspension 30-34. Standardmetoden för att expandera celler för forskning eller klinisk användning är som anhängare monolager på grund av enkel hantering. Vi har dock visat att passaging monolager och neurosfär hNPCs med enzymatiska eller kemiska lösningar resulterade i tidiga åldrande 35. Dessutom kan enzymatisk dissociation leda till ökade nivåer av differentiering och karyotypic avvikelser baserade på data visade med embryonala stamceller 36-38. Även standardmetod aging hNPCs har producerat ström god tillverkningssed (cGMP) kvalitet produkter som har gått in i fas 1 kliniska prövningar (Stem Cells Inc., Neuralstem Inc.), tillåts metoden bara några rundor av cell förstärkning, vilket begränsar bank potential.
Uppenbarligen kan stora forskningsexperiment och framtida kliniska försök dra nytta av möjligheten attföröka celler i bulk och med fördröjd åldrande att tillåta storskalig tillväxt och cellbanker. För att möta detta behov har vi utvecklat en ny och automatiserad sätt att mekaniskt aging intakta neurospheres med "hugga" dem i små grupper för att upprätthålla cell-till-cell kontakt. Denna metod kraftigt ökat deras livslängd 39 och suspensionskultur medger en mer effektiv användning av inkubatorn utrymme jämfört med monolagerkulturer, som sett med en alternativ 3D bioreaktor odlingsmetoden 40. Den tillhandahålls hack protokollet medger produktion av stora banker från ett foster prov större än passage 10, en osannolik bedrift med vanliga passaging metoder. Även om denna metod för passaging hNPCs är okonventionell, är det växer i popularitet och har nyligen publicerade med andra celltyper, t.ex. neurala stamceller från mänskliga embryonala och inducerade pluripotenta stamceller, som möjliggör storskalig utbyggnad för olika tillämpningar, inklusive i vITRO sjukdom modellering 41-46. Huvudsakligen har en cGMP-grade hNPC cellbank som redan tagits fram med huggmetoden, vilket visar att tekniken kan användas mot framtida kliniska applikationer.
Protocol
Representative Results
Discussion
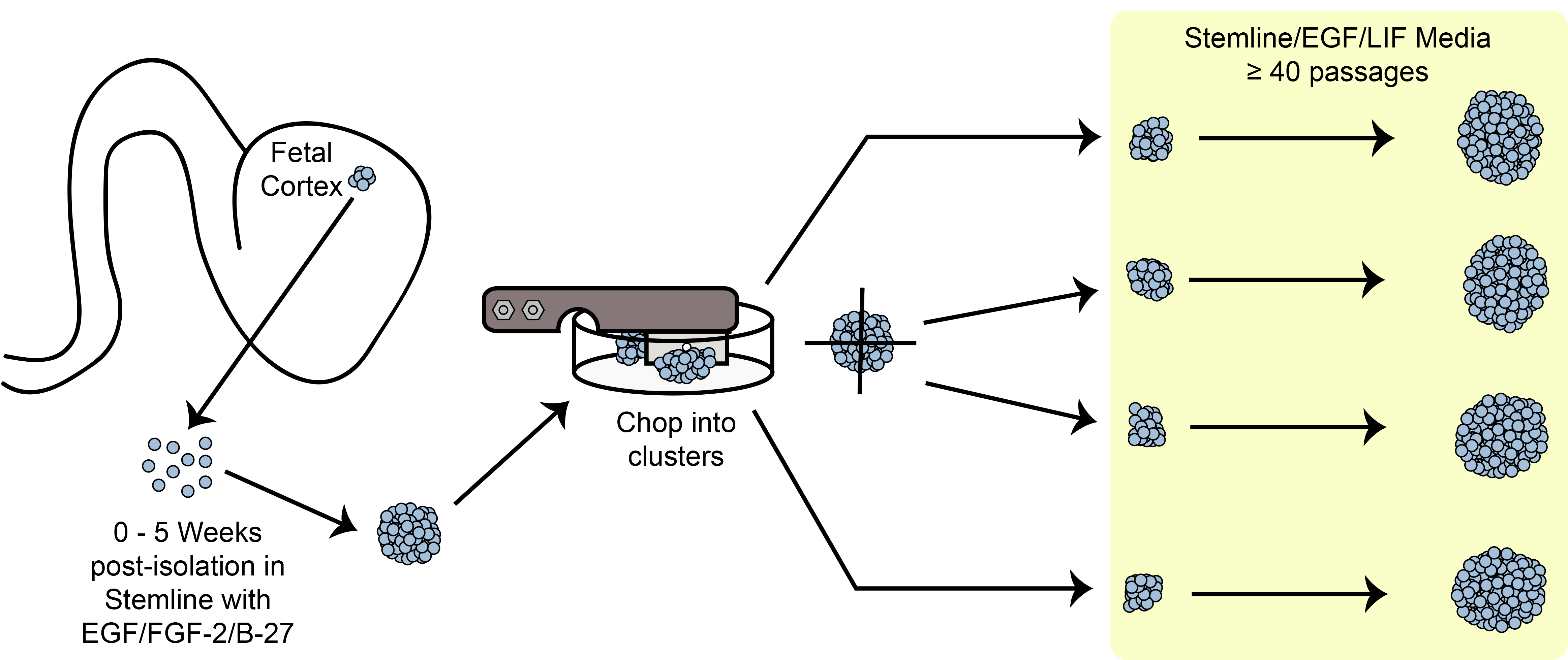
Figur 6. Hack Schematic. Expanderande sfäroid stam / progenitorceller i kultur med hjälp av den mekaniska hackmetoden.
Kritiska steg
En översikt av hackexpansions paradigmet visas i Figur 6. HNPC sfär storlek är ett av de viktigaste kriterierna för att observera innan ympa om…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi tackar Dr Soshana Svendsen för kritisk granskning och redigering av denna rapport. Detta arbete har bidragit till att av NIH / NINDS 1U24NS078370-01 och CIRM DR2A-05320.
Materials
| Beaker, 50 mL | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 mL inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 mL | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 mL | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 mL | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 mL | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 mL | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 mL | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern – Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37°C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1 – 10 μL | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100 – 1000 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2 – 20 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20 – 200 μL (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μL | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1000 μL | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μL | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μL | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 mL | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 mL | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 mL | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 mL | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1X) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neurosciences. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. -. IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson’s disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 .
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. i. P. S. C. Induced pluripotent stem cells from patients with Huntington’s disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).

