Hot Biologische Katalyse: Isothermisch titratiecalorimetrie om enzymatische reacties karakteriseren
Summary
Isothermische titratiecalorimetrie maatregelen warmtestroom vrijgelaten of geabsorbeerd in chemische reacties. Deze methode kan worden gebruikt voor enzym-katalyse kwantificeren. In deze paper, het protocol voor instrumentale setup, experiment loopt, en data-analyse wordt in het algemeen beschreven en toegepast op de karakterisering van enzymatische hydrolyse van ureum door jack bean urease.
Abstract
Isothermische titratie calorimetrie (ITC) is een goed beschreven techniek die meet de warmte die vrijkomt of geabsorbeerd tijdens een chemische reactie, te gebruiken als een intrinsieke probe vrijwel karakteriseren elk chemisch proces. Tegenwoordig wordt deze techniek op grote schaal toegepast op thermodynamische parameters van biomoleculaire bindingsevenwichten bepalen. Bovendien is ITC aangetoond kunnen rechtstreeks meten kinetiek en thermodynamische parameters (kcat, KM, AH) enzymatische reacties, hoewel deze toepassing nog onderbenut. Omdat warmte verandert spontaan optreden tijdens de enzymatische katalyse, heeft ITC geen wijziging of de etikettering van het systeem onder analyse nodig en kan in oplossing worden uitgevoerd. Bovendien moet de methode kleine hoeveelheid materiaal. Deze eigenschappen maken ITC een waardevolle, krachtig en uniek instrument om enzymkinetiek te bestuderen in verschillende toepassingen, zoals bijvoorbeeld geneesmiddelenonderzoek.
<p class = "jove_content"> In dit werk een experimentele ITC-gebaseerde methode om kinetiek en thermodynamica van enzymatische reacties te kwantificeren wordt grondig beschreven. Deze methode wordt toegepast op kcat en Km bepalen van de enzymatische hydrolyse van ureum door Canavalia ensiformis (Jack Bean) urease. Berekening van intrinsieke molaire enthalpie (AH int) van de reactie wordt uitgevoerd. De aldus verkregen waarden zijn in overeenstemming met eerdere gegevens in de literatuur, waaruit de betrouwbaarheid van de methode.Introduction
Kwantitatieve bepaling van biochemische reacties geeft inzicht in de biologische processen die aan de basis van het leven. Calorimetry biedt een label-free methode om kwantitatief karakteriseren vrijwel elke chemische reactie in oplossing. Deze techniek meet de warmte die vrijkomt of geabsorbeerd in de tijd, en dus een universeel detectiesysteem en een zeer gunstige methode om de hoeveelheid reagerende moleculen (bijvoorbeeld binding thermodynamica), alsmede de reactiesnelheid (dwz kinetiek) meten kwantificeren. Met name isothermische titratie calorimetrie (ITC) goedgekeurd als mogelijk om deze de thermodynamica van biomoleculaire evenwichten karakteriseren, waarbij eiwit-ligand, eiwit-eiwit, eiwit-metaalionen en eiwit-DNA-interacties 1-6. Bovendien is het vermogen van ITC kinetische informatie maakt het een zeer krachtig systeem enzym katalyse meten, hoewel het potentieel van deze toepassing nogonderschat 7-9.
De Michaelis-Menten-vergelijking 10 is een kwantitatieve beschrijving van enzymatische reacties, omdat het een relatie tussen de reactiesnelheid en de substraatconcentratie, afhankelijk van twee kinetische parameters: de Michaelis-constante (KM) en de katalytische snelheidsconstante (kcat) . De kcat / M-verhouding wordt aangeduid als de katalytische efficiëntie van een enzym. In de praktijk bepalen van K M en k kat voor een specifieke reactie geeft een volledige beschrijving van de katalyse.
Bij een kenmerkende enzymatische reactie (figuur 1), een substraat (S) samenwerkt met het enzym (E) die het enzym-substraat (ES) complex, dat vervolgens in de overgangstoestand is geactiveerd (ES *). Deze wordt omgezet in het enzym-product (EP) complex dat uiteindelijk dissocieert. Deze staps worden beschreven door de volgende reactie.
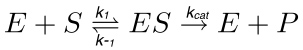 (1)
(1)
waarin k 1 is de snelheidsconstante voor de vorming van het ES-complex, k -1 is de snelheidsconstante voor de dissociatie van het ES-complex, terwijl kcat de snelheidsconstante of katalytische omzettingsgetal.
Volgens de Michaelis-Menten-vergelijking 10, kan de snelheid van de reactie als volgt berekend:
 (2)
(2)
waarbij K = M (k -1 + k cat) / k 1 en k cat = v max / [E] met v max wordt de maximale snelheid bereikt wanneer alle enzym gebonden aan het substraat.
De isothermische titratie calorimeter is het instrument in deze studie om de enzymatische hydrolyse van ureum karakteriseren. Dit instrument bestaat uit een adiabatische schild met twee gemunt-vormige cellen (Figuur 1). Deze zijn verbonden met de buitenzijde met smalle toegang buizen. De monstercel (ca. 1,4 ml) wordt geladen met de enzymoplossing, terwijl de referentiecel algemeen gevuld met water of met het oplosmiddel dat voor de analyse. Een roterende spuit met een lange naald en een roer paddle bevestigd, en doorgaans ca.. 0,3 ml substraatoplossing, is gemonteerd op de monstercel. Een thermo-elektrische apparaat meet het verschil in temperatuur tussen het monster en de referentie-cel en, met behulp van een "cel feedback netwerk", stelt zij dit verschil op nul door het optellen of aftrekken van warmte. Tijdens het experiment, wordt het substraat geïnjecteerd in de enzymoplossing op een constante gewenste temperatuur. Wanneer de nlzymatic reactie plaats, de hoeveelheid vrijkomende warmte of geabsorbeerd is evenredig met het aantal substraat moleculen die worden omgezet in product moleculen. Daarnaast wordt de snelheid van warmtestroom direct gerelateerd aan de snelheid van de reactie. De meetgegevens, die als afwijking van de verwarmingskabel uit nulmeting (figuur 1), vertegenwoordigen de thermische (μcal / s) geleverd door het instrument op de monstercel, dat evenredig is met de warmtestroom zich in de monstercel na verloop van tijd.

Figuur 1. Schematische weergave van isothermische titratie calorimeter enzymatische reacties bestuderen. Een enzymatische reactie die optreedt bij titratie van het substraat (in de injectiespuit) in de enzymoplossing (in de monstercel) resulteert in een verandering van de thermal macht vrijgegeven door de calorimeter, die nodig zijn om het verschil in temperatuur tussen het monster cel en de celverwijzing constant te houden. Klik hier voor grotere afbeelding.
Kortom, de warmteverandering (Q) is evenredig met de molaire enthalpie van de reactie (AH) en het aantal molen product verkregen (n), die op zijn beurt wordt gegeven door het totale maal de concentratie:
 (3)
(3)
De productvorming in tijd (dP / dt), die overeenkomt met de reactiesnelheid kunnen dus worden gerelateerd aan de hoeveelheid warmte die via gelijktijdig (dQ / dt) door de relatie:
 (4)
(4)
Volgens deze vergelijking om een Michaelis-Menten vinden plot dient te meten i) de totale molaire enthalpie AH, en ii) de warmtestroom dQ / dt bij verschillende substraatconcentraties. Gewoonlijk wordt dit in twee verschillende experimenten: in het eerste experiment (methode 1, M1), wordt het substraat geïnjecteerd in de enzymoplossing en de warmte voor volledige omzetting van het substraat wordt gemeten; in de tweede proef (Methode 2, M2), zijn meerdere injecties substraat uitgevoerd en de snelheid van de warmteproductie gemeten bij verschillende substraatconcentraties. Deze twee sets gegevens zijn voldoende om de kinetische parameters K M en k kat ontlenen.
In dit artikel wordt een algemeen protocol om de kinetische parameters voor enzymatische reacties uitgevoerd met behulp van ICT te bepalen beschreven. We pasten de methode om ureum hydrolyse door Canavalia ensiformis ureumse, als referentiesysteem. De goede overeenkomst tussen de zo verkregen resultaten en de gegevens in de literatuur toont de betrouwbaarheid van deze benadering.
Protocol
Representative Results
Discussion
Betekenis van ITC om enzymatische activiteit te bestuderen met betrekking tot bestaande methoden
Naast de klassieke toepassingen bindingsevenwichten bestuderen, isothermische titratie calorimetrie een betrouwbare en snelle methode om enzymatische reacties in oplossing karakteriseren met de reactiewarmte als een probe, zonder dat het systeem wijziging of labeling. De kinetische parameters kcat en Km worden gewoonlijk verkregen door een reeks tijdsverloop e…
Divulgations
The authors have nothing to disclose.
Acknowledgements
De gespecialiseerde meststoffen Company (SFP) is erkend voor het verstrekken van de nodige fondsen voor deze studie.
Materials
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
References
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research–survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).

