핫 생물 촉매 : 등온 적정 열량 효소 반응의 특성을
Summary
등온 적정 열량 측정 열 흐름이 방출 또는 화학 반응에 흡수. 이 방법은 효소 – 촉매 반응을 정량화하는데 사용될 수있다. 본 논문에서는 악기 설정을위한 프로토콜, 실험 실행 및 데이터 분석은 일반적으로 기술되고, 잭 콩 요소 분해 효소에 의해 가수 분해 효소 요소의 특성에 적용.
Abstract
등온 적정 열량 측정 (ITC)는 열이 거의 모든 화학적 프로세스를 특성화하기 위해 극한 프로브로서 사용하여, 화학 반응 동안 방출 또는 흡수 측정 잘 설명 된 기술이다. 현재에는,이 기술은 광범위 생체 분자 결합 평형의 열역학적 파라미터를 결정하기 위해 적용된다. 또한, ITC가 직접 응용 프로그램이 여전히 underexploited에도 불구하고, 효소 반응의 역학 및 열역학 매개 변수 (K 고양이, K M, ΔH)을 측정 할 수 있도록 입증되었습니다. 열 변화가 자발적 효소 촉매 반응 중에 발생하는 바와 같이, ITC는 분석중인 시스템의 변경이나 표시를 필요로하지 않고, 용액에서 수행 될 수있다. 또한,이 방법은 재료의 작은 금액을 필요로한다. 이러한 속성은 ITC로 다음과 같은 다양한 응용 프로그램, 예를 들어, 약물 발견에 효소 반응 속도를 연구하는, 귀중한 강력하고 독특한 도구합니다.
<p c이 작품 역학과 효소 반응의 열역학을 정량화 할 수있는 실험 itc 기반 방법에서 아가씨가 = "jove_content은"> 철저하게 설명되어 있습니다. 이 방법은 K 고양이를 결정하기 위해 적용되는 Canavalia의 ensiformis (잭 콩) 요소 분해 효소에 의한 요소의 효소 가수 분해의 K M. 반응의 고유 몰 엔탈피 (ΔH의 INT)의 계산이 수행된다. 얻어진 값은 방법론의 신뢰성을 보여주는, 문헌에보고 이전의 데이터와 일치한다.Introduction
생화학 반응의 정량은 삶의 기초에서 생물학적 과정에 대한 통찰력을 제공합니다. 열량은 양적 솔루션의 거의 모든 화학 반응의 특성에 레이블이없는 방법을 제공합니다. 이러한 기술은 열을 방출 또는 시간에 걸쳐 흡수 계측하고, 따라서 보편적 검출 시스템과 반응 분자 (즉, 결합 열역학)뿐만 아니라, 반응 속도 (즉, 반응 속도)을 측정하기위한 양을 정량화하는 매우 편리한 방법이다. 특히, 등온 적정 열량계 (ITC)는 단백질 – 리간드, 단백질 – 단백질, 단백질 – 금속 이온과 단백질-DNA 상호 작용 1-6을 포함, 생명 평형의 열역학 특성에 선택의 방법으로 채택하고있다. 본 출원의 전위가있을지라도 또, 운동 정보를 제공하기 위해 ITC의 능력은 그것의 효소 촉매 작용을 측정하는 매우 강력한 시스템 만든다7-9을 과소 평가.
미카엘리스 상수 (K M) 및 촉매 속도 상수 (k 고양이)는이 운동 매개 변수에 따라, 반응 속도와 기질의 농도 간의 관계를 제공하는 등 미카엘 – 멘텐 방정식 (10)은 효소 반응의 정량적 인 설명이다 . K 고양이는 / K M 비율은 효소의 촉매 효율로 언급된다. 실제로, 특정 반응에 대한 K M의 의지와 K 고양이는 촉매에 대한 자세한 설명을 제공합니다.
전형적인 효소 반응 (도 1)에서, 기판 (S)을 연속적으로 전이 상태로 활성화되는 효소 – 기질 (ES) 복합체를 형성하는 효소 (E), (ES *)와 상호 작용한다. 후자는 결국 해리 효소 제품 (EP) 단지로 변환됩니다. 이 단계(S)는 다음과 같은 반응에 의해 설명된다.
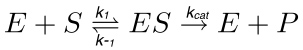 (1)
(1)
K 1은 ES 단지, K -1의 형성 속도 상수입니다 K 고양이 촉매 속도 상수 또는 회전율 수있는 동안, ES 복합체의 해리에 대한 속도 상수이다.
: 미카엘리스 – 멘텐 방정식 10에 따르면, 반응의 속도는 다음과 같이 계산 될 수있다
 (2)
(2)
하는 K M = (K -1 + K 고양이) / K 1과 K 고양이 = V 최대 / [E], V 최대 모든 효소가 기판에 바인딩 될 때 도달 최대 속도 인과.
등온 적정 열량계는 우레아의 가수 분해 효소의 특성을 본 연구에서 사용 된 수단이다. 이 기기는 두 개의 만들어 낸 모양의 세포 (그림 1)를 포함하는 단열 차폐 만든다. 이러한 좁은 프리 튜브와 외부에 접속된다. 기준 셀은 일반적으로 물 또는 분석을 위해 사용 된 용매로 충진되는 동안 샘플 셀 (약 1.4 ml)을, 효소 용액과 함께로드된다. 일반적으로 기질 용액 캘리포니아. 0.3 ML를 포함하는 긴 바늘과 연결된 교반 패들과 회전 주사기, 시료 셀에 장착된다. 열전 장치가 "셀 피드백 네트워크"를 사용하여, 시료 및 참조 셀 사이의 온도차를 측정하고, 그 열을 추가하거나 감산함으로써 제로의 차이를 유지한다. 실험하는 동안, 기판은 일정한 온도에서 선택된 효소 용액에 주입된다. 때 엔zymatic 반응물 방출 또는 흡수되는 열량이 상품 분자로 변환된다 기질 분자의 수에 비례하여, 일어난다. 또, 열 흐름의 속도를 직접 반응의 속도에 관한 것이다. 측정 된 데이터는, 초기 기준선에서 열 트레이스의 편차 (도 1)으로 나타나는 (μcal / 초) 샘플 셀에서 발생하는 열 유량에 비례하는 샘플 셀에 기기에 의해 공급 화력을 나타낸다 시간이 지남에.

그림 1. 효소 반응을 연구 등온 적정 열량계의 개략도. (샘플 셀에서) 거기의 변화의 결과로 효소 용액 (주입 주사기) 기판의 적정시 발생하는 효소 반응시료 셀과 기준 셀 상수 사이의 온도 차이를 유지하는 데 필요한 칼로리, 발표 한 말의 힘. 더 큰 이미지를 보려면 여기를 클릭하십시오.
전반적으로, 열 변화 (Q)을 반응 (ΔH)와 교대로 합계 양 배 농도 주어진다 (N), 생성 된 생성물의 몰수의 몰 엔탈피에 비례한다 :
 (3)
(3)
생성물 형성은 시간이 지남에 따라 반응 속도에 대응한다 (DP / DT)는, 이와 관련하여 통해 동시에 (dQ를 / DT) 위에 발열량 관련 될 수있다 :
 (4)
(4)
이 식에 따르면, 미카엘리스 – 멘텐를 얻기 위해는) 전체 몰 엔탈피 ΔH를 I를 측정하는 것이 필요하다 플롯 상이한 기질 농도에서 ⅱ) 열 흐름 dQ를 / DT. 일반적으로이 두 개의 상이한 실험에서 수행된다 : 첫 번째 실험 (방법 1, M1)에서, 기판이 효소 용액에 주입하고 완전한 기판 변환 용 히트가 측정된다; 두 번째 실험 (방법 2, M2)에서, 기판의 체류 주사가 수행되고, 열 생성 속도가 상이한 기질 농도에서 측정된다. 2 개의 데이터 세트는 운동 매개 변수 K M과 K 고양이를 유도하기에 충분하다.
본 기사에서는 ITC를 사용하여 수행 효소 반응에 대한 운동 매개 변수를 결정하는 일반적인 프로토콜이 설명되어 있습니다. 우리는 Canavalia ensiformis 요소에 의해 요소의 가수 분해 방법을 적용SE, 참조 시스템과 같은. 이 방법을 사용하여 얻은 결과와 문헌에보고 된 데이터와 잘 일치하는이 방법의 신뢰성을 보여줍니다.
Protocol
Representative Results
Discussion
기존의 방법과 관련하여 효소 활성을 연구하는 ITC의 의의
결합 평형을 연구의 고전 어플리케이션 이외에, 등온 적정 열량 측정 시스템 수정 또는 라벨링을 요구하지 않고, 프로브로서, 반응의 열을 사용하여 용액의 효소 반응의 특성을 안정적이고 빠른 방법을 제공한다. 운동 파라미터는 고양이 K와 K M은 보통 제품의 형성 (또는 기판 소비…
Divulgations
The authors have nothing to disclose.
Acknowledgements
특수 비료 제품 회사 (SFP)는이 연구에 필요한 자금을 제공하기 위해 인정 받고 있습니다.
Materials
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
References
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research–survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).

