Fluorescens Imaging med One-nanometer Noggrannhet (FIONA)
Summary
Enstaka fluoroforer kan lokaliseras med nanometerprecision med hjälp FIONA. Här en sammanfattning av den FIONA teknik rapporteras, och hur man utför FIONA experiment beskrivs.
Abstract
Fluorescens avbildning med en nanometer precision (FIONA) är en enkel men användbar teknik för att lokalisera enskilda fluoroforer med nanometerprecision i xy-planet. Här en sammanfattning av den FIONA teknik redovisas och exempel på forskning som har utförts med användning av FIONA beskrivs kortfattat. Först, hur man ställer in den nödvändiga utrustningen för FIONA experiment, det vill säga en total inre reflektion fluorescensmikroskopi (TIRFM), med information om att rikta optiken, beskrivs. Sen hur man genomför ett enkelt FIONA experiment på lokalisera immobiliserade Cy3-DNA enstaka molekyler med hjälp av lämpliga protokoll, följt av användning av FIONA att mäta 36 nm steget storleken på en enda stympad myosin Va motor märkt med en kvantprick, illustreras. Slutligen är senaste försök att utvidga tillämpningen av FIONA till tjocka prover rapporterades. Det visar sig att, med hjälp av en vattenimmersionsobjektiv och kvantprickar indränkt djupt i sol-geler och kaninögonhornhinnor (>200 | im), lokalisering precision 2-3 nm kan uppnås.
Introduction
Omkring 1882, Ernst Abbe fann att utgången av en synlig ljusmikroskop är ~ λ / 2NA, eller ~ 200 nm (där λ är våglängden och NA är den numeriska aperturen) 1,2. Därför något föremål som är mindre än detta mått skulle framstå som ett diffraktionsbegränsad plats i ett optiskt mikroskop. Emellertid är det möjligt att bestämma den centrala platsen, dvs placeringen av objektet, med en mycket högre precision 3. Fluorescens avbildning med en nanometer precision (FIONA) är en enkel men användbar teknik för att lokalisera enskilda fluoroforer med nanometerprecision i xy-planet 4. Precisionen av lokalisering, σ μ (dvs standardavvikelsen för medelvärdet), beror på det totala antalet insamlade fotoner, 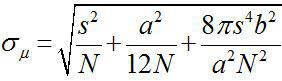 , Där N är fotonräkning, s är standardavvikelsen för den fluorescerande fläck, är enpixelstorleken av avbildningsdetektorn, och b är standardavvikelsen för bakgrunden 3,4. För en fluorofor avger ~ 10000 fotoner, kan FIONA uppnå ~ 1 nm precision 4.
, Där N är fotonräkning, s är standardavvikelsen för den fluorescerande fläck, är enpixelstorleken av avbildningsdetektorn, och b är standardavvikelsen för bakgrunden 3,4. För en fluorofor avger ~ 10000 fotoner, kan FIONA uppnå ~ 1 nm precision 4.
FIONA kan användas för att exakt bestämma läget för en stationär sändare, eller en rörlig en (förutsatt bilder kan tas tillräckligt snabbt). FIONA kan appliceras sekventiellt på ramarna i filmen och på så sätt spåra rörelse enda molekyl 4 8. Foto-skyddande reagenser kan vara nödvändiga för att säkerställa att provet inte photodegrade. Vidare kan det fluorescerande objektet i sig vara av vilken storlek, mindre eller större än den diffraktion begrän- t.ex. kan det bestå av en organell (~ 1 mikrometer) med många fluorescerande proteiner utspridda på dess membran. Använda FIONA kan ändå ge en mycket exakt (nanometer) genomsnittet av dess genomsnittliga center-of-massa. Den stora förbättringen i lokaliseringsprecision från FIONA tillåter lösa nanometer skala rörelser över tid. Detta har drivit mikroskopi i den molekylära längdskala 4 8.
Sedan uppfinning, har varianter av FIONA utvecklats. Exempelvis ljusfält avbildning med en nanometer precision (bFIONA) 9, en liten variant av FIONA, bilder och lokaliserar täta föremål såsom melanosomer vivo (mörka föremål som innehåller pigmentet melanin) i med genomlysning. Dessutom har FIONA använts för att lösa flera färgämnen. Exempelvis enda molekyl högupplösande avbildning med fotoblekning (räka) 10,11 eller enda molekyl högupplösande colocalization (SHREC) 12 har utvecklats för att lösa två färgämnen inom omkring 10 nm. (Observera att detta är upplösningen, det vill säga hur exakt man kan säga samma färger från varandra.) På senare tid har FIONA analysen bidragit till lokaliseringsprocessen av vissa superupplösning mikroskopi såsom stokastisk optisk reconstruction mikroskopi (STORM) 13-15 och fotoaktiverade lokalisering mikroskopi (PALM) 16, där tillfälliga mörka fluoroforer är glada, och sedan fluorescensen är lokaliserad. Genom att upprepade gånger spännande en ganska låg täthet av färgämnen (mindre än en per diffraktionsbegränsad fläck) och därefter uppsamling av fluorescens, analysera var och en av dem genom FIONA kan en bygga upp en högupplöst karta. Upplösningen är sedan bara begränsad av antalet fotoner varje färgämne ger ut, samt saker som att hålla prov stationära (inklusive t.ex. mikroskop scenen) vid förvärvet.
I detta papper, en sammanfattning av den FIONA Teknik och kortfattat beskriva exempel på forskning som har utförts med hjälp av FIONA rapporteras. Först, hur man ställer in den nödvändiga utrustningen för FIONA experiment, det vill säga en total inre reflektion fluorescensmikroskopi (TIRFM), med information om att rikta optiken, beskrivs. Sen hur mangenomföra en enkel FIONA experiment på lokalisera immobiliserade Cy3-DNA enstaka molekyler med hjälp av lämpliga protokoll, som är avbildad. Efter det, för att användningen av FIONA mäter 36 nm steget storleken på en enda stympad myosin Va motor märkt med en kvantprick presenteras. Myosin Va är en viktig processiv motorprotein som bär cellulära last samtidigt translokera längs aktinfilament. Här en myosin Va konstruera stympad används för att avlägsna domäner irrelevanta steget storlek och med en FLAG tagg läggs till i C-terminalen för att möjliggöra enkel märkning med kvantprickar funktion med Anti-FLAG-antikroppar. Detta experiment sker under lågt ATP att bromsa myosin och tillåta användandet av långa tillräckligt exponeringstider för att få en bra fotonräkning i varje ram. Alla tillräckligt ljusa fluorescerande märkning kan vara substituerade i följande protokoll. Slutligen är senaste insats för att utvidga tillämpningen av FIONA till tjocka prover rapporterades. Som ett proof-of-principle, var kvantprickar blöti sol-geler och kaninögonhornhinnor och sedan avbildas och lokaliseras med hjälp av FIONA. För avbildning, en 60X nedsänkning i vatten mål med NA = 1,2 användes eftersom detta mål har en längre arbetsavstånd än tidigare använda 100X oljeimmersionsobjektiv. För att kompensera förlusten i förstoring i målet, var en extra förstoringslins (3,3X eller 4,0X) insatt i vägen utsläpp. Dessutom epi-fluorescens (ej TIR) mikroskopi behöver användas för att få tillgång djupa regioner i de tjocka prover. Det visas att kvantprickar indränkt djupt i sol-geler och kaninögonhornhinnor (Z> 200 nm) kan lokaliseras med 2-3 nm precision.
Protocol
Representative Results
Discussion
FIONA är en teknik för att lokalisera positionen för en fluorescerande sändare (organisk fluorofor eller kvant prick) med nanometerprecision och tidsmässig upplösning ner till 1 ms 4 8. När tillräckligt många fotoner samlas, gör denna teknik för att bestämma positionen för en fluorescerande emitter mycket mer exakt än diffraktionsgränsen (~ 200 nm) och därmed denna teknik öppnar ett sätt att observera vad som inte setts med konventionell / traditionell optisk mikroskopi 4 – 8. Sed…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av NIH Grants 068.625, NSF Grants 1.063.188 och Center i fysik levande celler 0822613. särskilt tack går till Dr Marina Marjanovic i Beckman Institute for Advanced vetenskap och teknik för gåvan av kaninögon.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
References
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

