L'imagerie de fluorescence avec un nanomètre Précision (FIONA)
Summary
Fluorophores simples peuvent être localisés avec une précision nanométrique en utilisant FIONA. Voici un résumé de la technique FIONA est rapporté, et comment réaliser des expériences Fiona est décrit.
Abstract
imagerie de fluorescence avec une précision d'un nanomètre (FIONA) est une technique simple mais utile pour localiser fluorophores simples avec une précision nanométrique dans le plan xy. Voici un résumé de la technique FIONA est rapporté et des exemples de recherches qui ont été effectuées en utilisant FIONA sont brièvement décrits. Tout d'abord, comment mettre en place l'équipement nécessaire pour les expériences FIONA, c'est à dire, une microscopie de fluorescence à réflexion interne totale (TIRFM), avec plus de détails sur l'alignement de l'optique, est décrit. Alors comment réaliser une expérience FIONA simples sur la localisation de molécules simples Cy3 ADN immobilisé à l'aide des protocoles appropriés, suivis par l'utilisation de FIONA pour mesurer la taille de l'étape 36 nm d'un moteur Va myosine tronqué unique marqué par un point quantique, est illustré. Enfin, l'effort récent pour étendre l'application de FIONA à des échantillons d'épaisseur est rapporté. Il est montré que, en utilisant un objectif à immersion d'eau et les points quantiques trempé profondément dans sol-gels et les cornées l'œil de lapin (>200 um), la précision de localisation de 3.2 nm peut être obtenue.
Introduction
Autour de 1882, Ernst Abbe a constaté que la résolution d'un microscope à lumière visible est d'environ λ / 2NA, ou ~ 200 nm (où λ est la longueur d'onde et NA est l'ouverture numérique) 1,2. Par conséquent un objet plus petit que cette dimension apparaît comme une tache de diffraction limitée à un microscope optique. Cependant, il est possible de déterminer le centre de la tache, qui est la position de l'objet, avec une précision beaucoup plus élevée 3. imagerie de fluorescence avec une précision d'un nanomètre (FIONA) est une technique simple mais utile pour localiser fluorophores simples avec une précision nanométrique dans le plan xy 4. La précision de la localisation, σ μ (ie, l'erreur-type de la moyenne), dépend du nombre total de photons collectés, 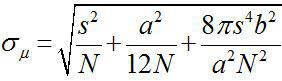 , Où N est le nombre de photons, s est l'écart-type de la tache fluorescente, est unla taille de pixel du détecteur de formation d'image, et b est l'écart type de la base de 3,4. Pour un fluorophore émettant de ~ 10 000 photons, FIONA peut atteindre 1 ~ 4 nm précision.
, Où N est le nombre de photons, s est l'écart-type de la tache fluorescente, est unla taille de pixel du détecteur de formation d'image, et b est l'écart type de la base de 3,4. Pour un fluorophore émettant de ~ 10 000 photons, FIONA peut atteindre 1 ~ 4 nm précision.
FIONA peut être utilisée pour déterminer avec précision la position d'un émetteur stationnaire, ou un un déplacement (en supposant que les images peuvent être prises assez rapidement). FIONA peut être appliqué séquentiellement aux images du film et donc de suivre le mouvement de la molécule unique 4 8. réactifs photo-protection peuvent être nécessaires pour s'assurer que l'échantillon ne photodégrader pas. En outre, l'objet lui-même fluorescent peut être de n'importe quelle taille, plus petite ou plus grande que la diffraction LIMIT- par exemple, il peut consister en un organite (~ 1 um) avec de nombreuses protéines fluorescentes dispersées sur sa membrane. Utilisation FIONA peut encore donner un très précise (nanomètre) moyenne de sa moyenne centre de masse. La grande amélioration de la précision de localisation par FIONA permet de résoudre nanomemouvements ter-échelle au fil du temps. Cela a poussé la microscopie dans l'échelle de longueur moléculaire du 4 au 8.
Depuis son invention, des variantes de FIONA ont été développés. Par exemple, l'imagerie à champ lumineux avec une précision d'un nanomètre (bFIONA) 9, une légère variante de FIONA, images et localise les objets denses tels que les mélanosomes vivo (objets sombres contenant les pigments de mélanine) dans avec la lumière transmise. En outre, FIONA a été utilisée pour résoudre plusieurs colorants. Par exemple, une seule molécule imagerie à haute résolution avec photoblanchiment (crevettes) 10,11 ou une seule molécule à haute résolution colocalisation (SHREC) 12 ont été développées pour résoudre deux colorants dans environ 10 nm. (Notez que c'est la résolution, c'est à dire avec quelle précision on peut dire colorants identiques à part.) Plus récemment, l'analyse FIONA a contribué au processus de localisation de certains microscopie de super-résolution comme reco optique stochastiquemicroscopie nstruction (STORM) du 13 au 15 et la localisation microscopie photo-activé (PALM) 16, dans lequel fluorophores sombres temporaires sont excités, puis la fluorescence est localisée. Par plusieurs reprises excitant assez faible densité de colorants (moins d'un par diffraction de place limité), puis à recueillir la fluorescence, analyse chacun d'eux par FIONA, on peut construire une carte à haute résolution. La résolution est alors seulement limité par le nombre de photons chaque colorant éteint, ainsi que des choses comme le maintien de l'échantillon fixe (y compris, par exemple, la platine du microscope) lors de l'acquisition.
Dans cet article, un résumé de la technique FIONA et décrire brièvement des exemples de recherches qui ont été effectuées à l'aide FIONA est rapporté. Tout d'abord, comment mettre en place l'équipement nécessaire pour les expériences FIONA, c'est à dire, une microscopie de fluorescence à réflexion interne totale (TIRFM), avec plus de détails sur l'alignement de l'optique, est décrit. Alors commentréaliser une expérience FIONA simples sur la localisation de molécules simples Cy3 ADN immobilisé à l'aide des protocoles appropriés, est illustré. Après cela, l'utilisation de FIONA pour mesurer la taille de pas de 36 nm d'un moteur de myosine Va tronqué unique marqué par un point quantique est présentée. Myosine Va est une protéine essentielle du moteur processive qui transporte des marchandises le long de la translocation cellulaire alors que les filaments d'actine. Voici une myosine Va construire tronquée est utilisée pour supprimer des domaines sans rapport avec la taille de l'étape, et avec une étiquette FLAG ajouté à l'extrémité C-terminale pour permettre la facilité d'étiquetage avec des points quantiques fonctionnalisés avec des anticorps anti-FLAG. Cette expérience est réalisée sous faible ATP pour ralentir la myosine et de permettre l'utilisation de longs temps d'exposition suffisant pour obtenir un bon nombre de photons dans chaque trame. Toute étiquette fluorescente suffisamment lumineuse pourrait être substitué dans le protocole suivant. Enfin, dernier effort d'étendre l'application de FIONA à des échantillons d'épaisseur est rapporté. Comme une preuve de principe, les points quantiques ont été trempésen sol-gel et les cornées l'œil de lapin puis imagé et localisée à l'aide FIONA. Pour l'imagerie, un objectif à immersion 60X d'eau avec NA = 1.2 a été utilisé parce que cet objectif a une distance plus de travail que précédemment utilisé 100X objectif à immersion d'huile. Pour compenser la perte dans le grossissement de l'objectif, une lentille supplémentaire grossissement (3.3X 4.0X ou) a été inséré dans le chemin d'émission. En outre, l'épi-fluorescence (pas TIR) microscopie doit être utilisé pour accéder à des régions profondes dans les échantillons épais. Il est démontré que les points quantiques trempés profonde dans sol-gels et cornées l'œil de lapin (Z> 200 um) peuvent être localisés avec précision 2-3 nm.
Protocol
Representative Results
Discussion
FIONA est une technique pour localiser la position d'un émetteur fluorescent (fluorophore organique ou points quantiques) avec une précision nanométrique et une résolution temporelle à 1 ms 4 8. Lorsque suffisamment de photons sont collectés, cette technique permet de déterminer la position d'un émetteur fluorescent beaucoup plus précise que la limite de diffraction (~ 200 nm) et donc cette technique ouvre la voie à observer ce qui n'a pas été vu en microscopie optique classique / trad…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par NIH Subventions 068 625, subventions de la NSF 1063188 et Centre de physique des cellules vivantes 0822613. Des remerciements spéciaux vont à Dr Marina Marjanovic dans Beckman Institute for Advanced Science et de la Technologie pour le don de l'œil du lapin.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
References
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

