Gene Transfeksjon mot spheroid Cells om Micropatterned Kultur tallerker genmodifiserte Cell Transplantation
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
For å forbedre den terapeutiske effektiviteten av celletransplantasjon, ble et system transplantasjon av genetisk modifiserte, injiserbare sfæroider utviklet. Celle sfæroider fremstilles i et kultursystem på micropatterned plater belagt med et thermo polymer. Et antall kuler er dannet på platene, som svarer til de områder av celle adhesjon 100 um diameter som er regelmessig stod i en todimensjonal måte, omgitt av ikke-klebende områder som er belagt med en polyetylenglykol (PEG) matrise. Sfæroidene kan lett utvinnes som en flytende suspensjon ved å senke temperaturen av platene, og deres struktur er godt vedlikeholdt ved å føre dem gjennom kanyler med en tilstrekkelig stor kaliber (over 27 G). Genetisk modifikasjon blir oppnådd ved transfeksjon gen hjelp av den opprinnelige ikke-virale gen bærer, POLYPLEX nanomicelle, som er i stand til å innføre gener i celler uten å forstyrre den sfæroide strukturen. For primAry hepatocytter sfæroider transfektert med luciferase-uttrykkende gen er luciferase bærekraftig oppnådd i transplanterte dyr, sammen med bevart hepatocytter funksjon, som angitt ved albumin uttrykk. Dette systemet kan brukes på en rekke celletyper, inkludert stamceller.
Introduction
Celletransplantasjon terapi har fått stor oppmerksomhet for behandling av ulike problematiske sykdommer. Aktiviteten og halveringstid av bioaktive faktorer som utskilles av de transplanterte cellene er viktig for forbedret terapeutisk effekt av et celletransplantasjon system. Genetisk modifikasjon av cellene før transplantasjonen er en fordelaktig teknikk for å regulere og manipulere cellulære funksjoner, inkludert sekresjon av bioaktive faktorer. Det er også viktig å opprettholde en gunstig mikromiljø for cellene for å unngå celledød eller tap av celleaktivitet. Tre-dimensjonale (3D) sfæroide cellekulturen, hvori celle-til-celle interaksjoner er godt bevart, er lovende for dette formål, for eksempel for forbedring av albumin sekresjon fra primære hepatocytter og fremme multilineær differensiering av stamceller (MSC ) 1-7.
I denne studien ble en ny kombinasjon system av spheroid kultur og genet transfeksjon blir brukt til å tjene som en plattform for genetisk modifisert celle transplantasjon. For å lage sfæroide celler, er en sfæroide kultursystem på micropatterned kulturplater brukt. På disse plater, blir celle adhesjon områder av 100 um diameter regelmessig oppstilt i en todimensjonal måte og er omgitt av ikke-klebende områder belagt med en matrise 3-PEG. Ved poding et tilstrekkelig antall celler, er rekker av 3D-sfæroider av 100 pm i diameter dannet svarende til micropatterned kulturen sengen.
Sfæroidene gjenvinnes uten å forstyrre deres 3D-struktur ved hjelp av termocellekulturplater, som var belagt med et termosensitivt polymer, poly (iso-propylacrylamide) (PIPAAm) 8-10. Den micropatterned arkitekturen er bygget på de termo plater (custom-bygget). Ved ganske enkelt å senke temperaturen av platene, blir sfæroidene løsrevet fra dyrkningsseng og spred i fosfatbufret saltvann (PBS). Således kan man få et stort antall sfæroider med ensartet størrelse på 100 um i form av en injiserbar suspensjon.
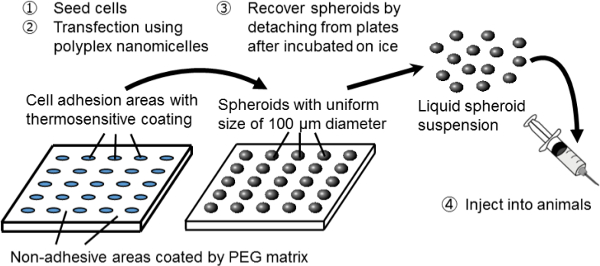
Figur 1. Skjematisk fremstilling av den sfæroide kultursystemet på en micropatterned plate. Genetisk modifikasjon blir oppnådd ved transfeksjon gen hjelp av den opprinnelige ikke-virale gen bærer, POLYPLEX nanomicelle. Det er sammensatt av plasmid DNA (pDNA) og polyetylenglykol (PEG) -polycation blokk-kopolymerer 11. Disse har en karakteristisk kjerne-skall struktur bestående av en PEG skall og en indre kjerne av kondensert pDNA, slik at sikker og effektiv genet innføring i celler for terapeutiske formål 11. Klikk her for å se en større versjon av this figur.
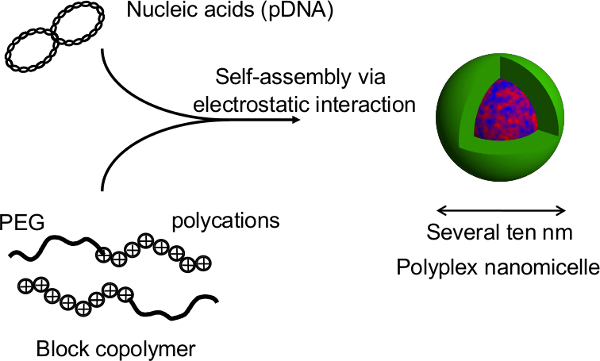
Figur 2. Oppbygging av POLYPLEX nanomicelle dannet ved kompleks av nukleinsyrer og PEG-blokk-polykation-blokk-kopolymerer. I denne studien, er den primære fordelen med denne teknikk at den sfæroide strukturen ikke blir forstyrret under genet transfeksjon av nanomicelles. Etter nanomicelle-mediert trans av rotte primære hepatocytter kuler, er langvarig transgene uttrykk innhentet for mer enn en måned med sammenhengende albumin sekret fra hepatocytter på et nivå som kan sammenlignes med utransfekterte kuler 12. Transgenet uttrykk og albumin sekresjon fra kulene er også opprettholdt etter at utvinningen fra termoplater. Det er åpenbart at nanomicelles trygt kan lette innføringen genet uten å svekke de medfødte funksjonene til hepatocytes. Dermed kombinasjonen av sfæroide celler dyrket på termo micropatterned plater med gen innføring bruker nanomicelles er en lovende plattform for genmodifiserte celletransplantasjon. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
I denne protokollen, er det viktig å opprettholde den 3D-strukturen til sfæroidene i løpet av trinnene med genet innføring og sfæroide utvinning. Det er viktig å opprettholde en gunstig mikromiljøer for cellene å unngå celledød eller tap av celleaktivitet. For eksempel albumin sekresjon, en representant medfødt funksjon av hepatocytter, er godt bevart i hepatocytter kuler, mens hepatocytter i den konvensjonelle enlagskultur raskt miste sin sekretorisk kapasitet et par dager etter såing 12. For MSC…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi setter stor pris på Dr. Takeshi Ikeya og teknisk personale i Toyo Gosei, Tokyo, Japan for å gi termo micropatterned kulturplater samt vitenskapelige råd. Vi takker også Ms Satomi Ogura, Ms. Sae Suzuki, Ms. Asuka Miyoshi og Ms. Katsue Morii for teknisk assistanse med dyreforsøk. Dette arbeidet ble finansiert delvis av JSP KAKENHI Grant-in-Aid for Scientific Research, Senter for innovasjon (COI) Program og S- innovasjonsprogram fra Japan Science and Technology Agency (JST), og JSP kjerne- to-kjerne program, A. Advanced Research Networks.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
References
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

