توليف فراغي للغاية من 1،6-Ketoesters وساطة من قبل أيوني السوائل: رد فعل ثلاثي مكون تمكين الوصول السريع إلى فئة جديدة من الاسعار المنخفضة الوزن الجزيئي Gelators
Summary
Ionic liquids (ILs) mediate fast, simple and cheap access to 1,6-ketoesters in high diastereoselectivities and good yields. The reaction protocol is robust and the 1,6-ketoesters can be obtained in gram scale after a simple filtration protocol. Moreover, the 1,6-ketoesters are potent gelators in hydrocarbon solvents.
Abstract
In organic chemistry ionic liquids (ILs) have emerged as safe and recyclable reaction solvents. In the presence of a base ILs can be deprotonated to form catalytically active N-Heterocyclic Carbenes (NHCs). Here we have used ILs as precatalysts in the addition of α,β-unsaturated aldehydes to chalcones to form 1,6-ketoesters, incorporating an anti-diphenyl moiety in a highly stereoselective fashion. The reaction has a broad substrate scope and several functional groups and heteroaromatics can be integrated into the ketoester backbone in generally good yields with maintained stereoselectivity. The reaction protocol is robust and scalable. The starting materials are inexpensive and the products can be obtained after simple filtration, avoiding solvent-demanding chromatography. Furthermore, the IL can be recycled up to 5 times without any loss of reactivity. Moreover, the 1,6-ketoester end product is a potent gelator in several hydrocarbon based solvents. The method enables rapid access to and evaluation of a new class of low molecular weight gelators (LMWGs) from recyclable and inexpensive starting materials.
Introduction
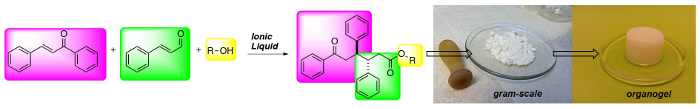
(فوق) تركيب ثلاثي مكون من 1،6-ketoesters: فئة جديدة من الاسعار المنخفضة gelators الوزن الجزيئي.
السوائل الأيونية (ILS) لديها استقرار عالية، وتقلب أسعار منخفضة، وعدم قابليتها للاشتعال، وبالتالي جعلت اهتمام وسائل الإعلام رد فعل آمنة والمذيبات مثالية لإعادة التدوير. 1-3 imidazoliums الألكيل هي نوع معين من السوائل الأيونية أنه في وجود قاعدة ، يمكن deprotonated لإصدار-N الحلقية غير المتجانسة carbene (NHC). 4 في مجال organocatalysis، NHCs، التي تعمل تحت مسارات رد فعل متميزة، وقد وجدت استخدام على نطاق واسع في مجموعة واسعة من ردود الفعل العامة. 5-11
وعلى الرغم من ذلك، فإن العلاقة بين ILS وformin السندات CCز NHC الحفز غير مستكشفة نسبيا. ومع ذلك، فقد تم الإبلاغ عن NHCs المستمدة من ILS لتحفيز CC السندات تشكيل ردود الفعل مثل التكثيف الجاوي وردود الفعل ستتر. 12-22 فعلى سبيل المثال، أظهرت ديفيس وآخرون أن ILS المستمدة من thiazoliums N-ألكيل بمثابة precatalysts في تشكيل الجاوي من بنزيلديهايد 12
في الآونة الأخيرة، وتشن وزملاء العمل توسيع هذا المفهوم باستخدام imidazolium استنادا IL، 1 إيثيل-3-الميثيل imidazolium خلات (EMIMAc)، لأداء التكثيف الجاوي على 5 hydroxymethylfurfural (HMF) لتوليد 5،5 '-di (hydroxymethyl) furoin (DHMF). 23 وبالنظر إلى أن وILS المتاحة تجاريا وتوفر وسيلة غير مكلفة لتوليد NHCs، ونحن مهتمون في التحقيق في ما أنواع أخرى من ردود الفعل ILS يمكن أن تؤدي. تحقيقا لهذه الغاية، وجدنا أن الألكيل imidazoliums يمكن أن تستخدم بكفاءة precatalysts في المترافقة additi الرسميعلى الألدهيدات غير المشبعة إلى الجالكونات (الشكل 1) إعطاء 1،6-ketoesters. وIL الأكثر كفاءة، EMIMAc، ويعزز رد فعل فراغي للغاية بين سينمالدهيد وكالكون. يحدث رد فعل مع تفضيل عالية لمكافحة -diastereomer و-ketoesters 1،6 يمكن عزل في عوائد تصل إلى 92٪. 24،25،26
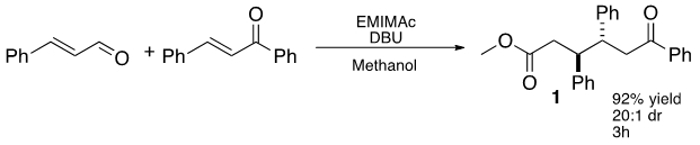
الشكل 1: IL بوساطة ثلاثة مكونات، بالإضافة فراغي من سينمالدهيد إلى كالكون.
Protocol
Representative Results
Discussion
استنادا إلى -configuration المضادة التي يحددها التحليل بالأشعة السينية ketoester 3 وعلى التحقيق الآلية التي اقترحها بوده وزملاء العمل 30 واقترح مسار التفاعل التالي (الشكل 5). نزع بروتون من IL يولد نوعا NHC. وNHC يتفاعل مع ألدهيد غير مشبعة لتشكيل بريسلو سيطة أولا بر…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We gratefully acknowledge the Swedish Research Council Formas for generous financial support.
Materials
| 1-ethyl-3-methyl imidazolium acetate | Aldrich | 51053-100G-F | Produced by BASF ≥90%, dried on a rotary evaporated before use (10 mBar, 40 °C, 1h) CAS NUMBER: 143314-17-4 |
| 1,3-diphenyl-2-propen-1-one | Aldrich | 11970-100G | 98.0% CAS NUMBER: 94-41-7 |
| trans-cinnamaldehyde | Aldrich | C80687-25G | 99%, stored under nitrogen prior to use CAS NUMBER: 14371-10-9 |
| 1,8-Diazobicyclo[5.4.0]undec-7-ene | Aldrich | 139009-25G | 98% CAS NUMBER: 6674-22-2 |
| Methanol | Sigma-Aldrich | 32213N-2.5L | puriss. P.a., ACS reagent, reag. ISO, reag. Ph. Eur. ≥99.8% (GC) CAS NUMBER: 67-56-1 |
| Dichloromethane | Fischer Chemical | D/1852/17X | Analytic reagent grade, stabilized with amylene CAS NUMBER:9/2/1975 |
| n-Heptane | Fischer Chemical | H/0160/17X | Analytic reagent grade CAS NUMBER: 142-82-5 |
References
- Hallett, J. P., Welton, T. Room-Temperature Ionic Liquids: Solvents for Synthesis and Catalysis. 2. Chem. Rev. 111, 3508-3576 (2011).
- Welton, T. Room-Temperature Ionic Liquids. Solvents for Synthesis and Catalysis. Chem. Rev. 99, 2071-2084 (1999).
- Vora, H. U., Wheeler, P., Rovis, T. Exploiting acyl and enol azolium intermediates via N-hetero- cyclic carbene-catalyzed reactions of α-reducible aldehydes. Adv. Synth. Catal. 354, 1617-1639 (2012).
- Holloczki, O., et al. Carbenes in ionic liquids. New J. Chem. 34, 3004-3009 (2010).
- Enders, D., Balensiefer, T. Nucleophilic Carbenes in Asymmetric Organocatalysis. Acc. Chem. Res. 37, 534-541 (2004).
- Enders, D., Niemeier, O., Henseler, A. Organocatalysis by N-Heterocyclic Carbenes. Chem. Rev. 107, 5606-5655 (2007).
- List, B. Enamine Catalysis Is a Powerful Strategy for the Catalytic Generation and Use of Carbanion Equivalents. Acc. Chem. Res. 37, 548-557 (2004).
- Nair, V., Bindu, S., Sreekumar, V. N-Heterocyclic carbenes: Reagents, not just ligands!. Angew. Chem. Int. Ed. 43, 5130-5135 (2004).
- Marion, N., Dìez-González, S., Nolan, S. P. N-Heterocyclic Carbenes as Organocatalysts. Angew. Chem. Int. Ed. 46, 2988-3000 (2007).
- Biju, A. T., Kuhl, N., Glorius, F. Extending NHC-Catalysis: Coupling Aldehydes with Unconventional Reaction Partners. Acc. Chem. Res. 44, 1182-1195 (2011).
- Bugaut, X., Glorius, F. Organocatalytic umpolung: N-heterocyclic carbenes and beyond. Chem. Soc. Rev. 41, 3511-3522 (2012).
- Davis, h. j., Forrester, K. J. Thiazolium-ion based organic ionic liquids (OILs).1,2 Novel OILs which promote the benzoin condensation. Tetrahedron Lett. 40, 1621-1622 (1999).
- Xu, L. -. W., Gao, Y., Yin, J. -. J., Li, L., Xia, C. -. G. Efficient and mild benzoin condensation reaction catalyzed by simple 1-N-alkyl-3-methylimidazolium salts. Tetrahedron Lett. 46, 5317-5320 (2005).
- Jiang, F. S., Yu, H., Gao, G., Xie, R. G. Benzoin condensation in imidazolium based room-temperature ionic liquids. Chin. Chem. Lett. 16, 321-324 (2005).
- Estager, J., Lévêque, J. M., Turgis, R., Draye, M. Solventless and swift benzoin condensation catalyzed by 1-alkyl-3-methylimidazolium ionic liquids under microwave irradiation. J. Mol. Catal. A: Chem. 256, 261-264 (2006).
- Estager, J., Lévêque, J. -. M., Turgis, R., Draye, M. Neat benzoin condensation in recyclable room-temperature ionic liquids under ultrasonic activation. Tetrahedron Lett. 48, 755-759 (2007).
- Orsini, M., Chiarotto, I., Elinson, M. N., Sotgiu, G., Inesi, A. Benzoin condensation in 1,3-dialkylimidazolium ionic liquids via electrochemical generation of N-heterocyclic carbene. Electrochem. Commun. 11, 1013-1017 (2009).
- Dunn, M. H., Cole, M. L., Harper, J. B. Effects of an ionic liquid solvent on the synthesis of [gamma]-butyrolactones by conjugate addition using NHC organocatalysts. RSC Advances. 2, 10160-10162 (2012).
- Kelemen, Z., Holloczki, O., Nagy, J., Nyulaszi, L. An organocatalytic ionic liquid. Org. Biomol. Chem. 9, 5362-5364 (2011).
- Yu, F. -. L., Zhang, R. -. L., Xie, C. -. X., Yu, S. -. T. Synthesis of thermoregulated phase-separable triazolium ionic liquids catalysts and application for Stetter reaction. Tetrahedron. 66, 9145-9150 (2010).
- Aupoix, A., Vo-Thanh, G. Solvent-free synthesis of alkylthiazolium-based ionic liquids and their use as catalysts in the intramolecular Stetter reaction. Synlett. , 1915-1920 (2009).
- Yu, F. -. L., Jiang, J. -. J., Zhao, D. -. M., Xie, C. -. X., Yu, S. -. T. Imidazolium chiral ionic liquid derived carbene-catalyzed conjugate umpolung for synthesis of [gamma]-butyrolactones. RSC Advances. 3, 3996-4000 (2013).
- Liu, D., Zhang, Y., Chen, E. Y. X. Organocatalytic upgrading of the key biorefining building block by a catalytic ionic liquid and N-heterocyclic carbenes. Green Chem. 14, 2738-2746 (2012).
- Ta, L., Axelsson, A., Bijl, J., Haukka, M., Sundén, H. Ionic Liquids as Precatalysts in the Highly Stereoselective Conjugate Addition of α,β-Unsaturated Aldehydes to Chalcones. Chem. Eur. J. 20, 13889-13893 (2014).
- Nair, V., et al. Nucleophilic Heterocyclic Carbene Catalyzed Annulation of Enals to Chalcones in Methanol: A Stereoselective Synthesis of Highly Functionalized Cyclopentanes. Org. Lett. 11, 2507-2510 (2009).
- Ma, J., Huang, Y., Chen, R. N-Heterocyclic carbene-catalyzed (NHC) three-component domino reactions: highly stereoselective synthesis of functionalized acyclic ϵ-ketoesters. Org. Biomol. Chem. 9, 1791-1798 (2011).
- Domingo, L. R., Saez, J. A., Arno, M. A DFT study on the NHC catalysed Michael addition of enols to α,β-unsaturated acyl-azoliums. A base catalysed C-C bond-formation step. Org. Biomol. Chem. 12, 895-904 (2014).
- Kaeobamrung, J., Mahatthananchai, J., Zheng, P., Bode, J. W. An Enantioselective Claisen Rearrangement Catalyzed by N-Heterocyclic Carbenes. J. Am. Chem. Soc. 132, 8810-8812 (2010).
- Zweep, N., van Esch, J. H. . Functional Molecular Gels. , 1-29 (2014).
- Chiang, P. -. C., Kaeobamrung, J., Bode, J. W. Enantioselective, Cyclopentene-Forming Annulations via NHC-Catalyzed Benzoin−Oxy-Cope Reactions. J. Am. Chem. Soc. 129, 3520-3521 (2007).

