Эндотелиальных клеток Planar Модель для работы с изображениями иммунологии Synapse Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
Адаптивного иммунитета регулируется динамического взаимодействия между Т-клетками и антиген-представляющих клеток ("БТР") называют «иммунологических синапсов». В этих интимных межклеточных интерфейсов дискретные суб-кластеры сотовой МНС / Ag-TCR, F-актина, адгезия и сигнальные молекулы образуют и быстро переделывать. Такая динамика, как считается, критические детерминанты как эффективность и качество иммунных ответов, которые развиваются, и поэтому защитных против патологического иммунитета. Современное понимание иммунологических синапсов с физиологической БТР ограничивается неадекватности получаемой разрешением изображения. Хотя искусственные модели подложки (например, плоские липидных бислоев) предлагают превосходное разрешение и чрезвычайно ценный инструмент, они по своей природе не физиологическая, а упрощенное. Сосудистые и лимфатические эндотелиальные клетки превратились в важную периферических тканей (или стромальных) отсеке "полу-профессииаль БТР. Эти бронетранспортеры (которые выражают большую часть молекулярных машин профессионального БТР) имеют уникальную особенность формирования практически плоскую поверхность клеток и легко transfectable (например, с флуоресцентным белком журналистами). В этом основной подход к осуществлению эндотелиальные клетки в качестве нового и физиологический "плоской модели сотовых APC 'для улучшения изображений и опроса основных антигенных обрабатывает сигнализацию будут описаны.
Introduction
Т-лимфоциты являются филиал адаптивной иммунной системы характеризуется способностью эффективно распознавать пептид антигена (АГ), связанного с главным комплексом гистосовместимости (МНС) молекул через их Т-клеточных рецепторов (TCR) 1. Наивные лимфоциты мигрируют конструктивно и сканирования »профессиональные Ag представляющих клеток (АПК»; например, дендритные клетки) в лимфатических узлах, в то время как память / эффекторные Т-клетки должны эффективно обследовать чрезвычайно широкий спектр БТР и потенциальных целевых клеток в периферических тканях.
В следующем мин первоначального признания родственных Ag на БТР, лимфоциты арестовать их миграции и начинают формировать специализированные интимную интерфейс клетка-клетка называется "иммунологическое синапсов» (IS). Устойчивый (т.е. 30-60 мин) контакты должны усиливать и поддерживать сигнализации 2-7. Новые исследования определить, что в есть, это непрерывное образование и быстрое гemodeling дискретных субклеточном сигнализации микро-кластеров (т.е., содержащих МНС / Ag-TCR, F-актин, адгезию и сигнальные молекулы), которые определяют силу и качество в результате иммунных ответов 2-7. Тем не менее, динамические данные и механизм регулирования этого процесса полностью понял 8,9. Это связано в основном с техническими проблемами, связанными с неправильной топологии поверхностей APC и плохо контролируемой ориентации плоскостей взаимодействия клетка-клетка, вопросов, которые глубоко ограничивают необходимую пространственно-временной обработки изображений подходов 8-10 (Figure1A).
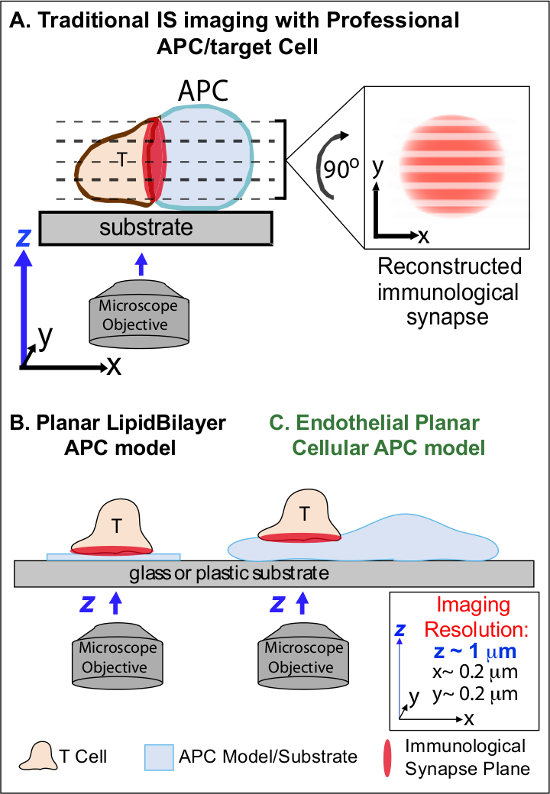
Рисунок 1. Физиологическая Planar сотовый APC Модель изображений иммунологии Synapse Dynamics. Схема иллюстрирует традиционный изображений иммунологической синапса между Т-клетки и профес NAL APC (А) и Т-клеток и традиционный плоский липидов модель бислой APC (В) по сравнению с этой новой модели эндотелиальной плоской APC (C). Профессиональные БТР обеспечить физиологические иммунологические синапсы, но предлагают мало ориентированный интерфейс клетка-клетка (т.е., по отношению к оптимальной плоскости изображения ху, разрешение ~ 0,2 мкм), что резко компрометирует пространственное (г визуализации самолет разрешения ~ 1 мкм) и временная (т.е. в связи с необходимостью многократно сканировать всех плоскостях изображений г) разрешение изображения. Двухслойные модели имеют плоскую топологию, что обеспечивает оптимальную пространственно-временной изображения разрешением, но также сильно упрощенной, не физиологические и жесткой. Это эндотелия модель сотового сочетает в себе плоскую топологию липидного бислоя с физиологической подложки классического APC, чтобы доставить оптимального пространственное и временное разрешение изображений в физиологическом обстановке.м / файлы / ftp_upload / 53288 / 53288fig1large.jpg "целевых =" _blank "> Нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Предыдущие исследования частично обойдена эти препятствия путем разработки моделей плоскую подложку (т.е. липидных бислоев и поверхностей покрытых антителами), которые обеспечивают оптимальную пространственно-временной разрешение (т.е. с помощью фиксации поверхность активации Т-клеток в единый план, параллельной оптимальной визуализации ху Плоскость) 11-15 (Фигура 1В). Эти модели способствовали важные идеи в субклеточных / молекулярной динамики, которые контролируют антигенный сигнализации в Т-клетках, в том числе открытие динамического актина / TCR сигнализации микро-кластеров 7,11-14. Тем не менее, такие модели изначально упрощать, а также жесткой (исключающее развитие / изучение 3-мерных топологических особенностей) (рис 1B). Таким образом, остается неясным, как связать такие выводы PHYsiologic клетка-клетка иммунный надзор.
Хотя до сих пор изучено недостаточно, сосудистой и лимфатические эндотелиальные клетки возникают, как большой (т.е. больше, чем в цифрах всех профессиональных БТР, на ~ 1000 раз) периферической отсеке "полу-профессиональной" БТР 16-18. Эти клетки экспрессируют MHC-I-, MHC-II- и множество молекул со-стимуляторов (например, CD40, LFA3, ICOSL, 4-1ВВ, OX40L, TL1A, PD-L1, но не CD80 и CD86) и стратегически расположенный на границе кровь-ткань, где они служат специализированные функции дозорных 16-18. Предыдущие исследования показали, что эндотелиальные клетки могут эффективно повторно стимулировать эффекторной / память, но не наивным, Т-клетки 19-25. Таким образом, эндотелиальные клетки, вероятно, играют уникальную роль в эффекторной APC фазе адаптивных иммунных реакций в пределах периферических тканях, таких как локального воздействия на активацию Т-клеток, дифференцировки, памяти и толерантности 16,17,26. Крически, при выращивании в пробирке, эндотелиальные клетки образуют практически плоские поверхности клеток и легко transfectable (например, с флуоресцентным белком журналистами). Эти особенности идеально подходят для высокой пространственно-временной разрешающей способностью топологических динамики при межклеточных взаимодействий 19,27. Таким образом, эндотелиальные клетки может служить физиологический "плоской сотовой APC» модели отчетливо подходит для изучения субклеточных / молекулярные механизмы ремоделирования, которые управляют распознавания антигенов и регулируют ответов (рис 1в) 19,20.
Ранее установлено, комплементарные методы визуализации (в том числе трансфекции эндотелии клеток с флуоресцентными производителей белка мембраны плазмы и цитозоле) для изучения деталей лейкоцитов-эндотелиальной взаимодействия при адгезии и трансэндотелиальной миграции 27, показали, что лейкоциты активно зондировать поверхность эндотелии динамического вставкад втягивание субмикронных масштабах, актин-богатых цилиндрические выступы (~ 200-1000 нм в диаметре и глубиной) называется invadosome, как выступы (то есть, "ILPs ') 27,28. Эти подходы изображений были расширены наряду с созданием протоколов, чтобы воспользоваться функцией эндотелия APC развивать первые методы пространственно-временной высокой разрешающей способностью в Т-клеток-эндотелиальной иммунологической синапса Как сообщалось 19,20 и далее описанных здесь. Центральный вывод, производный от этого романа плоской модели APC сотовой том, что Т-клеточные ILPs функционировать как в поощрении начального обнаружения Ag и в поддержании последующее сигнализации. В самом деле, массивы нескольких ILPs (которые были стабилизированы и начисленных в ответ на начальный поток кальция) Показать обогащение TCR и молекул наводящий активного сигнального такой ПКС-Q, ZAP-70, фосфотирозина и HS1. Таким образом, ILPs-видимому, представляют собой трехмерную физиологическую эквивалентную ТКР сигнализации микрокластеры видели в плоских моделей двухслойных. Этот подход, таким образом, чутко показывает / отчеты молекулярные и архитектурные (и подразумеваемые биомеханические) динамика не иначе обнаруживается.
Метод, описанный в данном документе должны быть полезными для преодоления разрыва между профессиональной APC и искусственных моделей APC субстрата для того, чтобы укрепить нашу способность допросить основные механизмы адаптивного иммунного ответа. В то время как здесь акцент делается на активацию CD4 + Th1-типа эффектора / ячейки памяти, это основной подход можно легко модифицировать для изучения широкий спектр типов Т-клеток и AGS, как описано ниже.
Protocol
Representative Results
Discussion
В целом, этот протокол описывает методы исследования эндотелиальные клетки, как я) изученных физиологических БТР и II) в качестве нового типа из "плоского клеточной модели APC». Что касается первого, то стал все более и более очевидно, что без гемопоэтических периферических (или «строма…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

