דגם תא האנדותל מישורי הדמיה החיסוני סינפסה Dynamics
Summary
Adaptive immunity is controlled by dynamic ‘immunological synapses’ formed between T cells and antigen presenting cells. This protocol describes methods for investigating endothelial cells both as understudied physiologic APCs and as a novel type of ‘planar cellular APC model’.
Abstract
חסינות מסתגלת מוסדרת על ידי אינטראקציות דינמיות בין תאי T ותאי הצגת אנטיגן ('נגמ"שים') המכונה "סינפסות החיסונית". בתוך ממשקי תאי תאים האינטימיים אלה אשכולות בדידים משנה הסלולר של MHC / Ag-TCR, F- אקטין, הדבקה ויוצרים מולקולות איתות ולשפץ במהירות. דינמיקה אלה נחשבות לגורמים קריטיים של שתי היעילות והאיכות של התגובות חיסוני המתפתחות ולכן של מגן לעומת חסינות פתולוגיים. הבנה נוכחית של סינפסות החיסונית עם נגמ"שים פיסיולוגיים היא מוגבלת על ידי חוסר ההתאמה של הרזולוציה ההדמיה השגה. למרות שמודלים מלאכותיים מצע (למשל, bilayers שומנים מישוריים) מציעים רזולוציה מעולה והיו כלים יקרים מאוד, הם מטבעם אינו פיסיולוגיים ופשטניים. תאי האנדותל של כלי דם והלימפה צמחו כתא רקמה היקפית חשובה (או סטרומה) של 'חצי מקצועאל נגמ"שים ". נגמ"שים אלה (המבטאים ביותר של המכונות מולקולריות של נגמ"שים מקצועיים) יש התכונה הייחודית של יצירת תא שטח כמעט מישורי והם בקלות transfectable (למשל, עם כתבי חלבון פלואורסצנטי). במסמך גישה בסיסית ליישום תאי האנדותל כרומן ו'מודל APC הסלולרי מישוריים 'פיסיולוגי להדמיה וחקירה של תהליכי איתות אנטיגני הבסיסיים משופרות תתואר.
Introduction
לימפוציטים מסוג T הוא סניף של המערכת החיסונית אדפטיבית המאופיינת ביכולת לזהות ביעילות אנטיגן פפטיד (Ag) חייבת מורכב histocompatibility גדול (MHC) מולקולות באמצעות קולטנים של תאי T (TCRs) 1. לימפוציטים נאיביים constitutively להעביר ולסרוק תאים מקצועיים Ag הצגה '(נגמ"שים; למשל, תאים דנדריטים) בתוך בלוטות הלימפה, בעוד תאי הזיכרון / T מפעיל צריכים לסקור מגוון רחב מאוד של נגמ"שים ותאי יעד פוטנציאליים בתוך רקמות היקפי ביעילות.
בדקות הבאות הכרה ראשונית של Ag מקור על APC, ימפוציטים לעצור הגירתם ומתחיל להיווצר ממשק תאי תאים אינטימי מיוחד "סינפסה החיסונית 'כינתה (IS). ספג (כלומר, 30-60 דקות) היא קשר נדרש להגביר ולקיים איתות 2-7. מחקרים המתעוררים לזהות שבתוך הוא, זה הוא ההיווצרות רציפה ומהיר remodeling של מיקרו-אשכולות בדידים איתות תת-תאי (כלומר, מכילים MHC / Ag-TCR, F- אקטין, הדבקה ומולקולות איתות) הקובעים את החוזק והאיכות של תגובות חיסוני וכתוצאה מכך 2-7. עם זאת, פרטים דינמיים ומנגנון רגולציה של תהליך זה באופן חלקי הבינו 8,9. זה נובע במידה רבה מאתגרים טכניים הקשורים בטופולוגיות סדירות של משטחי APC ונטייה גרועים מבוקרת של מטוסי האינטראקציה תאי תאים, נושאים שעמוקים להגביל את ההדמיה spatiotemporal הנדרשת גישות 8-10 (Figure1A).
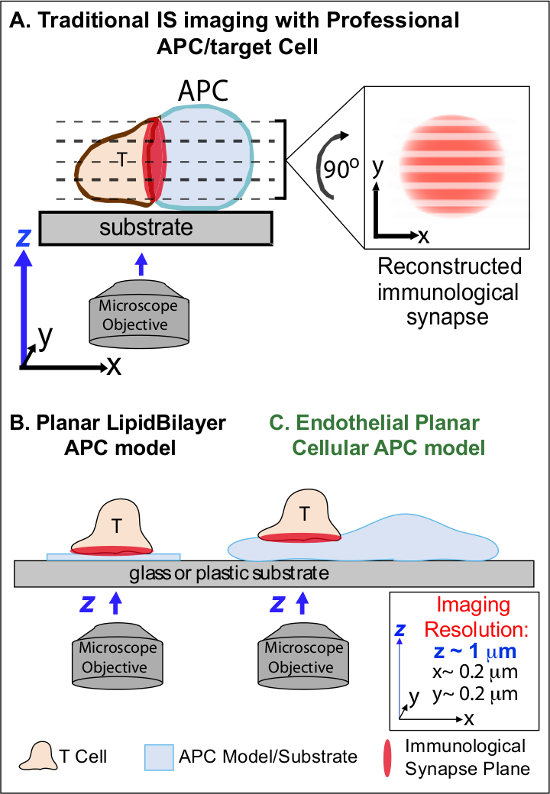
איור 1. דגם APC התא פיסיולוגי מישורי הדמיה החיסוני סינפסה Dynamics. סכמטי ממחיש הדמיה מסורתית של סינפסה החיסונית בין תאי T וprofessio תא סופי APC () ו- T ומודל מסורתי שומנים מישוריים APC bilayer (ב ') בהשוואה למודל זה רומן אנדותל APC מישוריים (C). נגמ"שים מקצועיים לספק סינפסות החיסונית פיזיולוגית אבל מציעים ממשק מונחה גרוע תא-תא (כלומר, ביחס למישור ההדמיה XY האופטימלי; רזולוציה ~ 0.2 מיקרומטר), אשר באופן דרמטי פוגע מרחבית (רזולוציה ~ מיקרומטר מטוס ההדמיה z 1) ובזמן (כלומר, בשל הצורך לסרוק שוב ושוב בכל מטוסי ההדמיה z) רזולוציה של הדמיה. יש דגמי bilayer טופולוגיה מישוריים המספקת רזולוציה ההדמיה spatiotemporal אופטימלית, אבל גם פשוטים ביותר, שאינם פיסיולוגי ונוקשה. מודל תא האנדותל זה משלב את הטופולוגיה מישוריים של bilayers שומנים עם המצע הפיזיולוגי של APC קלאסי כדי לספק רזולוציה הדמיה מרחב ובזמן אופטימלית בסביבה פיזיולוגית.מ '/ קבצים / ftp_upload / 53,288 53288fig1large.jpg "target =" / _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
העבודה קודמת עקפה באופן חלקי על המכשולים הללו על ידי פיתוח מודלים מצע מישוריים (כלומר, bilayers שומנים ומשטחים מצופים נוגדנים) המספקים רזולוציה spatiotemporal אופטימלית (כלומר, באמצעות תיקון משטח הפעלת תא T לתכנית אחת שמקבילה להדמית XY האופטימלית מטוס) 11-15 (1B איור). מודלים אלה הקלו תובנות חשובות דינמיקת subcellular / מולקולרית השולטות איתות אנטיגני בתאי T, כוללים גילוי אקטין דינמי / TCR מיקרו-אשכולות איתות 7,11-14. עם זאת, מודלים כאלה מטבעם פשטניים, כמו גם נוקשה (מניעת הפיתוח / המחקר של תכונות טופולוגי 3 ממדים) (איור 1). לכן, זה עדיין לא ברור איך להתייחס כגון ממצאים לPHYתאי תאים siologic מעקב חיסוני.
למרות שעדיין understudied, כלי דם ותאי האנדותל הלימפה הם מתעוררים כגדולים (כלומר, גדולים יותר במספרים מכל נגמ"שים המקצועיים, על ידי ~ 1000-פי) תא היקפי של נגמ"שים "חצי מקצועי" 16-18. תאים אלה מבטאים MHC-אני-, MHC-II- ושפע של מולקולות שיתוף ממריץ (למשל, CD40, LFA3, ICOSL, 4-1BB, OX40L, TL1A, PD-L1, אבל לא CD80 וCD86) ואסטרטגיים ממוקם בממשק שבין דם לרקמה שבו הם משרתים פונקציות זקיף מיוחדות 16-18. מחקרים קודמים הראו שתאי האנדותל יכולים למעשה מחדש לעורר מפעיל / זיכרון, אבל לא נאיבי, תאי T 19-25. כך, תאי האנדותל עשויים לשחק תפקידי APC ייחודיים בשלב מפעיל של תגובות חיסוניים אדפטיבית בתוך הרקמות ההיקפית, כגון השפעה מקומית על הפעלת תא T, בידול, זיכרון וסובלנות 16,17,26. CRItically, כאשר גדלו במבחנה, תאי האנדותל יוצרים משטחי תא כמעט מישורי והם בקלות transfectable (למשל, עם כתבי חלבון פלואורסצנטי). תכונות אלה הן אידיאליים עבור הדמיה גבוהה spatiotemporal רזולוציה של דינמיקה טופולוגית במהלך אינטראקציות תא-תא 19,27. כך תאי האנדותל עשויים לשמש כמודל 'מישוריים סלולארי APC' פיסיולוגי מובהק מתאים ללימוד מנגנוני שיפוץ subcellular / מולקולריים המניעה את הכרת אנטיגן ולווסת תגובות (איור 1 ג) 19,20.
בעבר הוקם טכניקות הדמיה משלימות (כולל transfection של תאי endothelia עם מקבלי חלבון פלואורסצנטי של קרום הפלזמה וcytosol) ללומד את הפרטים של אינטראקציה ליקוציט-האנדותל בהידבקות וההגירה Transendothelial 27, הראה כי לויקוציטים באופן פעיל לחקור את פני השטח של האנדותל ידי דינמי הכנסהההכחשה ד של תת-מיקרון בקנה מידה, בליטות גליליות אקטין עשיר (~ 200-1,000 ננומטר בקוטר ועומק) כינו בליטות כמו invadosome (כלומר, 'ILPs') 27,28. הדמיה גישות אלה הורחבו עוד יותר יחד עם יצירת הפרוטוקולים לנצל פונקצית APC אנדותל לפתח השיטות הראשונות להדמיה גבוהה spatiotemporal רזולוציה של סינפסה החיסונית תא אנדותל T כ19,20 דיווח ועוד לתאר זאת. ממצא מרכזי הנגזר ממודל APC סלולארי זה מישוריים רומן הוא שILPs תא T לתפקד גם בקידום זיהוי Ag ראשוני ובשמירת איתות שלאחר מכן. ואכן, מערכים של ILPs מרובה (שהתייצבו ונצבר בתגובה הראשונית שטף סידן) להעשרת תכנית בTCR ומולקולות רמיזות של PKC-Q איתות פעילה כגון, ZAP-70, phosphotyrosine וHS1. לכן, ILPs נראה לייצג מקביל פיסיולוגי תלת-ממדית למייקרו-TCR האיתותאשכולות ראו בדגמי bilayer מישוריים. גישה זו, ובכך, ברגישות מגלה / דינמיקה מולקולרית ואדריכלית (ומשתמע ביו-מכאנית) דיווחים לא אחרת לזיהוי.
השיטה המתוארת במסמך זה צריכה להיות שימושי לגישור על הפער בין APC המקצועי ודגמי מצע APC מלאכותיים כדי לשפר את היכולת שלנו לחקור את המנגנונים בסיסיים של תגובות חיסוניים אדפטיבית. ואילו כאן הדגש הוא על ההפעלה של מפעיל CD4 + סוג Th1 / תא זיכרון, גישה בסיסית זו ניתן לשנות בקלות ללמוד מגוון רחב של סוגי תאי T וAGS, כמפורט להלן.
Protocol
Representative Results
Discussion
בסך הכל, פרוטוקול זה מתאר שיטות לחקירת תאי האנדותל כט) נגמ"שים פיסיולוגיים understudied וii) כסוג חדש של 'מודל APC הסלולרי מישוריים'. עם כל כבוד ללשעבר, זה הפך להיות יותר ויותר מוערך שנגמ"שים שאינם hematopoietic ההיקפי (או 'סטרומה') ממלאים תפקידים קריטיים, שאינם מיותרים <em…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We thank Dr. Peter T. Sage for his assistance in generating some of the representative images. This work was supported by an NIH R01 grant to C.V.C. (HL104006).
Materials
| BD Vacutainer stretch latex free tourniquet | BD Biosciences | 367203 | |
| BD alcohol swabs | BD Biosciences | 326895 | |
| BD Vacutainer Safety-Lok | BD Biosciences | 367861 | K2 EDTA |
| BD Vacutainer Push Button Blood Collection Set | BD Biosciences | 367335 | |
| RPMI-1640 | Sigma-Aldrich | R8758-1L | |
| Ficoll-Paque | Sigma-Aldrich | GE17-1440-02 | Bring to RT before use |
| FCS-Optima | Atlanta Biologics | s12450 | Heat inactivated |
| Penicillin-Streptomycin | Sigma-Aldrich | P4458-100ML | |
| Trypan blue | Sigma-Aldrich | T8154-20ML | |
| staphylococcal enterotoxin B | Toxin Technology | BT202RED | Stock solution 1mg/ml in PBS |
| toxic shock syndrome toxin 1 | Toxin Technology | TT606RED | Stock solution 1mg/ml in PBS |
| human IL-15 | R&D Systems | 247-IL-025 | Stock solution 50ug/ml in PBS |
| PBS | Life Technologies | 10010-049 | |
| Fibronectin | Life Technologies | 33016-015 | Stock solution 1mg/ml in H20 |
| HMVEC-d Ad-Dermal MV Endo Cells | Lonza | CC-2543 | Other Human Microvascular ECs can be used, i.e. HLMVECs |
| EGM-2 MV bullet kit | Lonza | CC-3202 | |
| Trypsin-EDTA | Sigma-Aldrich | T-4174 | Stock solution 10x, dilute in PBS |
| amaxa-HMVEC-L Nucleofector Kit | Lonza | vpb1003 | Required Kit for step 4 |
| IFN-g | Sigma-Aldrich | I3265 | Stock solution 1mg/ml in H20 |
| TNF-alpha 10ug, human | Life Technologies | PHC3015 | Stock solution 1mg/ml in H20 |
| phenol Red-free HBSS | Life Technologies | 14175-103 | |
| Hepes | Fisher Scientific | BP299-100 | |
| Calcium Chloride | Sigma-Aldrich | C1016-100G | Stock solution 1M in H20 |
| Magnesium chloride | Sigma-Aldrich | 208337 | Stock solution 1M in H20 |
| Human Serum albumin | Sigma-Aldrich | A6909-10ml | |
| Immersol 518 F fluorescence free Immersion oil | Fisher Scientific | 12-624-66A | |
| Fura-2 AM 20x50ug | Life Technologies | F1221 | Stock solution 1mM in DMSO |
| pEYFP-Mem (Mem-YFP) | Clontech | 6917-1 | |
| pDsRed-Monomer (Soluble Cytoplasmic DsRed) | Clontech | 632466 | |
| pDsRed-Monomer Membrane (Mem-DsRed) | Clontech | 632512 | |
| pEGFP-Actin | Clontech | 6116-1 | |
| Alexa Fluor 488 Phalloidin | Life Technologies | A12379 | |
| Formaldehyde solution 37% | Fisher Scientific | BP531-500 | Toxic, use fumehood |
| Triton X-100 | Sigma-Aldrich | X100-5ML | |
| Falcon 15mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-70C | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-49A | |
| Falcon Tissue Culture Treated Flasks T25 | Fisher Scientific | 10-126-9 | |
| Falcon Tissue Culture Treated Flasks T75 | Fisher Scientific | 13-680-65 | |
| Corning Cell Culture Treated T175 | Fisher Scientific | 10-126-61 | |
| Glass coverslips | Fisher Scientific | 12-545-85 | 12 mm diameter |
| Falcon Tissue Culture Plates 24-well | Fisher Scientific | 08-772-1 | |
| Delta-T plates | Bioptechs | 04200415B | |
| Wheaton Disposable Pasteur Pipets | Fisher Scientific | 13-678-8D | |
| 1.5 ml Eppendorf tube | Fisher Scientific | 05-402-25 | |
| ICAM1 mouse anti-human | BD Biosciences | 555509 | |
| HS1 mouse anti-human | BD Biosciences | 610541 | |
| Anti-Human CD11a (LFA-1alpha) Purified | ebioscience | BMS102 | |
| Anti-Human CD3 Alexa Fluor® 488 | ebioscience | 53-0037-41 | |
| Anti-MHC Class II antibody | Abcam | ab55152 | |
| Anti-Talin 1 antibody | Abcam | ab71333 | |
| Anti-PKC theta antibody | Abcam | ab109481 | |
| phosphotyrosine (4G10 Platinum) | Millipore | 50-171-463 | |
| Nucleofector II | Amaxa Biosystems | Required electroporator for step 4 | |
| Zeiss Axiovert | Carl Zeiss MicroImaging | ||
| Zeiss LSM510 | Carl Zeiss MicroImaging | ||
| Zeiss Axiovison Software | Carl Zeiss MicroImaging | ||
| NU-425 (Series 60) Biological Safety Cabinet | NuAIRE | Nu-425-600 | |
| Forma STRCYCLE 37 °C, 5% CO2 Cell culture Incubator | Fisher Scientific | 202370 | |
| Centrifuge 5810 | Eppendorf | EW-02570-02 | |
| Hemocytometer | Sigma-Aldrich | Z359629 | Bright-Line Hemocytometer |
| Isotemp Waterbath model 202 | Fisher Scientific | 15-462-2 |
References
- von Andrian, U. H., Mackay, C. R. T-cell function and migration. Two sides of the same coin. N. Engl. J. Med. 343 (14), 1020-1034 (2000).
- Springer, T. A. Adhesion receptors of the immune system. Nature. 346 (6283), 425-434 (1990).
- Shaw, A. S., Dustin, M. L. Making the T cell receptor go the distance: a topological view of T cell activation. Immunity. 6 (4), 361-369 (1997).
- Monks, C. R., Freiberg, B. A., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Delon, J., Stoll, S., Germain, R. N. Imaging of T-cell interactions with antigen presenting cells in culture and in intact lymphoid tissue. Immunol Rev. 189, 51-63 (2002).
- Brossard, C., et al. Multifocal structure of the T cell – dendritic cell synapse. Eur J Immunol. 35 (6), 1741-1753 (2005).
- Dustin, M. L. The cellular context of T cell signaling. Immunity. 30 (4), 482-492 (2009).
- Balagopalan, L., Sherman, E., Barr, V. A., Samelson, L. E. Imaging techniques for assaying lymphocyte activation in action. Nat Rev Immunol. 11 (1), 21-33 (2011).
- Cebecauer, M., Spitaler, M., Serge, A., Magee, A. I. Signalling complexes and clusters: functional advantages and methodological hurdles. J Cell Sci. 123, 309-320 (2010).
- Oddos, S., et al. High-speed high-resolution imaging of intercellular immune synapses using optical tweezers. Biophys J. 95 (10), L66-L68 (2008).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Bunnell, S. C., et al. T cell receptor ligation induces the formation of dynamically regulated signaling assemblies. J Cell Biol. 158 (7), 1263-1275 (2002).
- Yokosuka, T., et al. Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat Immunol. 6 (12), 1253-1262 (2005).
- Seminario, M. C., Bunnell, S. C. Signal initiation in T-cell receptor microclusters. Immunol Rev. 221, 90-106 (2008).
- Dustin, M. L. Supported bilayers at the vanguard of immune cell activation studies. J Struct Biol. 168 (1), 152-160 (2009).
- Martinelli, R., Carman, C. V., Bradshaw, R. A., Stahl, P. Lymphocyte Endothelilal Interactions. Encyclopedia of Cell Biology. , (2015).
- Choi, J., Enis, D. R., Koh, K. P., Shiao, S. L., Pober, J. S. T lymphocyte-endothelial cell interactions. Annu Rev Immunol. 22, 683-709 (2004).
- Marelli-Berg, F. M., Jarmin, S. J. Antigen presentation by the endothelium: a green light for antigen-specific T cell trafficking?. Immunol Lett. 93 (2-3), 109-113 (2004).
- Sage, P. T., et al. Antigen recognition is facilitated by invadosome-like protrusions formed by memory/effector T cells. J Immunol. 188 (8), 3686-3699 (2012).
- Kumari, S., et al. Actin foci facilitate activation of the phospholipase C-gama in primary T lymphocytes via the WASP pathway . eLife. , (2015).
- Marelli-Berg, F. M., et al. Major histocompatibility complex class II-expressing endothelial cells induce allospecific nonresponsiveness in naive T cells. J Exp Med. 183 (4), 1603-1612 (1996).
- Ma, W., Pober, J. S. Human endothelial cells effectively costimulate cytokine production by, but not differentiation of, naive CD4+ T cells. J Immunol. 161 (5), 2158-2167 (1998).
- Perez, V. L., Henault, L., Lichtman, A. H. Endothelial antigen presentation: stimulation of previously activated but not naive TCR-transgenic mouse T cells. Cell Immunol. 189 (1), 31-40 (1998).
- Epperson, D. E., Pober, J. S. Antigen-presenting function of human endothelial cells. Direct activation of resting CD8 T cells. J Immunol. 153 (12), 5402-5412 (1994).
- Shiao, S. L., et al. Human effector memory CD4+ T cells directly recognize allogeneic endothelial cells in vitro and in vivo. J Immunol. 179 (7), 4397-4404 (2007).
- Marelli-Berg, F. M., Okkenhaug, K., Mirenda, V. A two-signal model for T cell trafficking. Trends Immunol. 28 (6), 267-273 (2007).
- Carman, C. V., et al. Transcellular diapedesis is initiated by invasive podosomes. Immunity. 26 (6), 784-797 (2007).
- Carman, C. V. Mechanisms for transcellular diapedesis: probing and pathfinding by ‘invadosome-like protrusions’. J Cell Sci. 122 ((Pt 17)), 3025-3035 (2009).
- Dustin, M. L., Tseng, S. Y., Varma, R., Campi, G. T. T cell-dendritic cell immunological synapses. Curr Opin Immunol. 18 (4), 512-516 (2006).
- Saito, T., Yokosuka, T. Immunological synapse and microclusters: the site for recognition and activation of T cells. Curr Opin Immunol. 18 (3), 305-313 (2006).
- Gomez, T. S., et al. HS1 functions as an essential actin-regulatory adaptor protein at the immune synapse. Immunity. 24 (6), 741-752 (2006).
- Burbach, B. J., Medeiros, R. B., Mueller, K. L., Shimizu, Y. T-cell receptor signaling to integrins. Immunol Rev. 218, 65-81 (2007).
- Vicente-Manzanares, M., Sanchez-Madrid, F. Role of the cytoskeleton during leukocyte responses. Nat Rev Immunol. 4 (2), 110-122 (2004).
- Ma, Z., Janmey, P. A., Finkel, T. H. The receptor deformation model of TCR triggering. Faseb J. 22 (4), 1002-1008 (2008).
- Ma, Z., Sharp, K. A., Janmey, P. A., Finkel, T. H. Surface-anchored monomeric agonist pMHCs alone trigger TCR with high sensitivity. PLoS Biol. 6 (2), e43 (2008).
- Groves, J. T. Bending mechanics and molecular organization in biological membranes. Annu Rev Phys Chem. 58, 697-717 (2007).
- Xu, C., et al. Regulation of T cell receptor activation by dynamic membrane binding of the CD3epsilon cytoplasmic tyrosine-based motif. Cell. 135 (4), 702-713 (2008).

