Dynamisk Elektrokjemisk Måling av kloridioner
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
En kloridion sensor basert på overgangstidsmåling av en Ag / AgCl-elektrode er presentert. Målet er å unngå de iboende driver under langvarig kontinuerlig overvåking av kloridioner i elektrolytten. Chronopotentiometric målingen, som er en dynamisk måling tilnærming, av en Ag / AgCl-elektrode blir brukt til dette formål. Her en hastighet på endring av potensialet til en Ag / AgCl-elektrode blir målt i løpet av en stimulus (galvano puls). Fordelen med denne tilnærmingen er demonstrert av Elgar væske-krysset referanseelektrode, og i stedet bruke noen metalltråd som en pseudo-referanseelektrode, derfor tillater påvisning av CL ioner konsentrasjon for langtids (år) og in situ-programmer, for eksempel måling inne betongkonstruksjoner.
Kloridioner i betongkonstruksjoner er en av de viktigste årsakene til nedbrytning 1,2. Det initierer gropkorrosjon i armeringsstålet ennd resultater i den endelige svikt av konstruksjonen 3. Derfor er måle Cl-ioner i betong er uunngåelig å forutsi levetid og vedlikeholdssyklus av en struktur 4,5. Ulike måleprinsipper har blitt rapportert for klorid ion måling i betong som elektro 6,7, optisk 8,9 og elektro 10,11. Men optiske og elektromagnetiske metoder har store oppsett, er vanskelige å integrere som et frittstående system og har problemer med selektivitet 12. I elektroteknikk, potensiometrisk måling av en Ag / AgCl elektrode er state of the art tilnærming 6,7,13. Til tross for lovende resultater, er denne tilnærmingen begrenset til lab-skala måling siden fonnene i referansepotensial og diffusjon potensielle slipp resulterer i mangelfulle data 14,15. En overgang tid tilnærming basert på den dynamiske elektrokjemiske måle (DEM) kunne løse problemet på grunn av potensielledrift 16.
I DEM, er systemets respons til et påført stimulus måles 17-19. Det eksempel på et slikt system er chronopotentiometry. Her anvendes en strømpuls blir brukt som en stimulans tappe ioner i nærheten av elektrodeoverflaten og den tilsvarende potensialet respons blir målt. En anodisk strøm på en Ag / AgCl elektrode initierer et Faraday-reaksjon (Ag + Cl 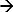 AgCl + e) som resulterer i en reduksjon av CL ioner nær elektroden overflaten. Potensialet endringen er en funksjon av den påtrykte strøm og konsentrasjonen av (selektive) ioner i elektrolytten 12,20. I det øyeblikk disse ionene utarme helt nær elektrodeoverflaten av endringstakten av potensielle stiger raskt, noe som gir et vendepunkt 21. Infleksjonspunktet på responskurven potensial-tid (chronopotentiogram) viser overgangs tid og kan bestemmes framaksimum av den første deriverte av den potensielle respons 22. Overgangstiden er karakteristisk for den ionekonsentrasjon. Denne tilnærmingen har vært brukt til å bestemme forskjellige ioner konsentrasjon 17 og pH i elektrolytter 23,24. I tilfelle en Ag / AgCl elektrode som en arbeidselektrode (som strøm brukes) tappe ionene blir kloridioner 17. Derfor måle sin overgang tid vil avgjøre sin konsentrasjon.
AgCl + e) som resulterer i en reduksjon av CL ioner nær elektroden overflaten. Potensialet endringen er en funksjon av den påtrykte strøm og konsentrasjonen av (selektive) ioner i elektrolytten 12,20. I det øyeblikk disse ionene utarme helt nær elektrodeoverflaten av endringstakten av potensielle stiger raskt, noe som gir et vendepunkt 21. Infleksjonspunktet på responskurven potensial-tid (chronopotentiogram) viser overgangs tid og kan bestemmes framaksimum av den første deriverte av den potensielle respons 22. Overgangstiden er karakteristisk for den ionekonsentrasjon. Denne tilnærmingen har vært brukt til å bestemme forskjellige ioner konsentrasjon 17 og pH i elektrolytter 23,24. I tilfelle en Ag / AgCl elektrode som en arbeidselektrode (som strøm brukes) tappe ionene blir kloridioner 17. Derfor måle sin overgang tid vil avgjøre sin konsentrasjon.
Protocol
Representative Results
Discussion
Overgangen tid er det øyeblikk av bøyning; Det er teoretisk sett uavhengig av referansepotensialet dvs. referanseelektroden. Derfor er en hvilken som helst metalltråd kan anvendes som en pseudo-referanseelektrode for overgang tidsmålinger. I motsetning til eksisterende potensiometrisk måling av kloridioner i betong denne metoden muliggjør en langvarig og kalibrering fri måling. Videre sensitivitet og påvisning konsentrasjonsområde kan være innstilt ved å justere den påtrykte strømpulsen. For høyer…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

