Dinâmica eletroquímico Medição de íons cloreto
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
Um sensor de iões cloreto com base na medição do tempo de transição de um eléctrodo de Ag / AgCl é apresentada. O objectivo é evitar os desvios inerentes durante a monitorização em contínuo a longo prazo dos iões de cloreto no electrólito. medição cronopotenciometria, que é uma abordagem dinâmica de medição, de um eléctrodo de Ag / AgCl é utilizado para esta finalidade. Aqui, uma taxa de variação do potencial de um eléctrodo de Ag / AgCl é medida durante um estímulo (pulso galvanostático). A vantagem desta abordagem é demonstrada por evitar o eléctrodo de referência líquida de junção e, em vez de usar qualquer fio de metal como um eléctrodo de pseudo-referência, portanto, permitindo a detecção de Cl concentração de iões para a longo prazo (anos) e em aplicações in situ, tal como medição dentro de estruturas de concreto.
Os iões cloreto em estruturas de betão é uma das principais causas de degradação 1,2. Ele inicia corrosão localizada no reforço de aço and resultados na falha final da estrutura 3. Portanto, medir iões Cl no concreto é inevitável para prever o ciclo de vida de serviço e manutenção de um 4,5 estrutura. Princípios de Detecção diferentes foram relatados para a medição de iões de cloreto no concreto, como eletroquímica 6,7, 8,9 e óptica eletromagnética 10,11. No entanto, métodos ópticos e eletromagnéticos têm configurações volumosos, são difíceis de integrar como um sistema stand-alone e têm problemas com seletividade 12. Na técnica electroquímica, medição potenciométrica de um eléctrodo de Ag / AgCl é o estado da arte 6,7,13 abordagem. Apesar dos resultados promissores, esta abordagem é limitada a medição em escala de laboratório uma vez que os desvios no potencial de referência e de difusão de resultados potenciais de queda em dados falhos 14,15. Uma abordagem tempo de transição com base na medição electroquímica dinâmico (DEM) pode aliviar o problema devido ao potencialderiva 16.
No DEM, a resposta do sistema a um estímulo aplicado é medido 17-19. O exemplo de um tal sistema é cronopotenciometria. Aqui, um impulso de corrente aplicada é utilizada como um estímulo esgotar iões perto da superfície do eléctrodo e o potencial de resposta correspondente é medida. Uma corrente anódica a um eléctrodo de Ag / AgCl inicia uma reacção faradaica (Ag + Cl 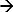 AgCl + E), resultando em uma depleção de íons Cl perto da superfície do eletrodo. O potencial alteração é uma função da corrente aplicada e a concentração dos iões (selectivos) do electrólito 12,20. No momento em que estes íons esgotar completamente perto do eletrodo de superfície a taxa de mudança de potenciais aumenta rapidamente, dando um ponto de inflexão 21. O ponto de inflexão sobre a curva de resposta em tempo potencial (chronopotentiogram) mostra o tempo de transição e pode ser determinada a partir damáximo da primeira derivação do potencial de resposta 22. O tempo de transição é uma característica da concentração iónica. Esta abordagem tem sido usada para determinar a concentração diferentes iões 17 e o pH de electrólitos 23,24. No caso de um eléctrodo de Ag / AgCl como um eléctrodo de trabalho (em que a corrente é aplicada) os iões esgotam será iões cloreto 17. Portanto medir o seu tempo de transição irá determinar a sua concentração.
AgCl + E), resultando em uma depleção de íons Cl perto da superfície do eletrodo. O potencial alteração é uma função da corrente aplicada e a concentração dos iões (selectivos) do electrólito 12,20. No momento em que estes íons esgotar completamente perto do eletrodo de superfície a taxa de mudança de potenciais aumenta rapidamente, dando um ponto de inflexão 21. O ponto de inflexão sobre a curva de resposta em tempo potencial (chronopotentiogram) mostra o tempo de transição e pode ser determinada a partir damáximo da primeira derivação do potencial de resposta 22. O tempo de transição é uma característica da concentração iónica. Esta abordagem tem sido usada para determinar a concentração diferentes iões 17 e o pH de electrólitos 23,24. No caso de um eléctrodo de Ag / AgCl como um eléctrodo de trabalho (em que a corrente é aplicada) os iões esgotam será iões cloreto 17. Portanto medir o seu tempo de transição irá determinar a sua concentração.
Protocol
Representative Results
Discussion
O tempo de transição é o momento de inflexão; é teoricamente independente da isto é, potencial de referência, o eléctrodo de referência. Por conseguinte, qualquer fio metálico pode ser utilizado como um eléctrodo de pseudo-referência para medições de tempo de transição. Em contraste com a medição potenciométrica existente de iões cloreto no betão este método permite que a longo prazo e calibração da medição livre. Além disso, a sensibilidade e a gama de detecção de concentr…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

