Non-invasiv Elektrisk hjernestimulering Montages for Modulation of Human Motor Function
Summary
Non-invasiv elektrisk hjernestimulering kan modulere kortikal funksjon og adferd, både for forskning og kliniske formål. Denne protokollen beskriver forskjellige hjerne stimulering fremgangsmåter for modulering av den humane motorsystem.
Abstract
Ikke-invasiv elektro hjernestimulasjon (NEBS) blir brukt til å modulere hjerne funksjon og virkemåten, både for forskning og kliniske formål. Spesielt kan NEBS påføres transcranially enten som likestrøm stimulering (tDCS) eller vekselstrøm stimulerings (TACS). Disse stimulerings typer utøve tids-, dose- og i tilfelle av tDCS polaritet-spesifikke effekter på motorikk og ferdigheter læring hos friske personer. I det siste tDCS har blitt brukt for å forsterke behandlingen av motoriske vansker hos pasienter med hjerneslag eller bevegelsesforstyrrelser. Denne artikkelen gir en steg-for-steg-protokollen for å målrette den primære motor cortex med tDCS og transkranial tilfeldig støy stimulering (Ovfø), en spesiell form for kvoter ved hjelp av en elektrisk strøm som brukes tilfeldig innenfor et forhåndsdefinert frekvensområdet. Oppsettet av to forskjellige stimulerings montasjer forklares. I begge montasjer den emitterende elektrode (anoden for tDCS) er plassert på den primære motor cortex av interesse. Tilensidig motor cortex stimulering den mottakende elektrode er plassert på den kontralaterale panne mens for bilateral motor cortex stimulering den mottakende elektrode er plassert på den motsatte primære motor cortex. De fordeler og ulemper ved hver montage for modulering av kortikal eksitabilitet og motorisk funksjon inkludert læring blir diskutert, samt sikkerhet, toleranse og blendende aspekter.
Introduction
Non-invasiv elektrisk hjernestimulering (NEBS), administrasjon av elektriske strømmer til hjernen gjennom intakt skallen, kan endre hjernens funksjon og adferd 1-3. For å optimalisere den terapeutiske potensialet i Nebs strategier forstå de underliggende mekanismene som fører til nevrofysiologiske og atferdsmessige effekter er fortsatt nødvendig. Standardisering av søknad på tvers av ulike laboratorier og full åpenhet om stimuleringsprosedyrer gir grunnlag for sammenlignbarhet av data som støtter pålitelig tolkning av resultater og evaluering av den foreslåtte virkningsmekanismer. Transkranial likestrøm stimulering (tDCS) eller transkranial vekselstrøm stimulering (TACS) avviker med parameterne for det påførte elektriske strøm: tDCS består av en ensrettet konstant strømflyt mellom to elektroder (anode og katode) 2 – 6 mens TACS anvender en vekselstrøm tilført ved enspesifikk frekvens 7. Transkranial tilfeldig støy stimulering (Ovfø) er en spesiell form for kvoter som bruker vekselstrøm brukes på tilfeldige frekvenser (f.eks., 100-640 Hz) som resulterer i raskt varierende stimulerings intensiteter og fjerne polaritet relaterte effekter 4,6,7. Polariteten er bare relevant dersom stimulering innstillingen inneholder en stimulering offset, for eksempel støy spekteret tilfeldig endring rundt en 1 mA baseline intensitet (vanligvis ikke brukt). For hensikten med denne artikkelen, vil vi fokusere på arbeid med tDCS og Ovfø effekter på motoriske system, nøye følge en fersk publikasjon fra vår lab 6.
De underliggende virkningsmekanismer av Ovfø er enda mindre forstått enn av tDCS men trolig forskjellig fra sistnevnte. Teoretisk sett, i det konseptuelle rammen av stokastisk resonans TRNS innfører stimulering-indusert støy til en neuronal system som kan tilveiebringe et signalbehandlings fordel ved å endre the signal-til-støy-forhold 4,8,9. TRNS kan hovedsakelig forsterke svake signaler og kan dermed optimalisere oppgavespesifikke hjernens aktivitet (endogen støy 9). Anodisk tDCS øker kortikal eksitabilitet indikert ved endring av spontan nevronal utløsning hastighet 10 eller økt motor fremkalt potensial (MEP) amplituder 2 med effekter utspilte stimulering varighet i minutter til timer. Varige økninger i synaptic effekt kjent som langsiktig potense er tenkt å bidra til læring og hukommelse. Faktisk øker anodisk tDCS synaptiske effekten av motor kortikale synapser gjentatte ganger aktiveres av en svak synaptisk inngang 11. I samsvar, er forbedret motorikk / ferdighet oppkjøpet ofte avslørt bare hvis stimulering er co-påføres med motor trening 11-13, også foreslå synaptisk co-aktivering som en forutsetning for denne aktiviteten avhengig prosess. Likevel årsakssammenheng mellom økninger i cortical oppstemthet (økning i avfyring hastighet eller MEP amplitude) på den ene siden og forbedret synaptisk effektivitet (LTP eller atferdsmessige funksjon som motorisk læring) på den annen side har ikke blitt vist.
NEBS tilført til den primære motor cortex (M1) har tiltrukket seg økende interesse som sikker og effektiv metode for å modulere human motorisk funksjon 1. Nevrofysiologiske effekter og atferds utfallet kan være avhengig av stimulering strategi (f.eks tDCS polaritet eller Ovfø), elektrode størrelse og montasje 4 – 6,14,15. Bortsett fra emne iboende anatomiske og fysiologiske faktorer elektroden montage påvirker betydelig elektrisk felt distribusjon og kan resultere i forskjellige mønstre av nåværende sprer innenfor cortex 16-18. I tillegg til intensiteten av den påførte strøm av størrelsen av elektrodene bestemmer strømtettheten levert 3. Felles elektrode montasjeri menneskelig motor systemstudier omfatter (figur 1): 1) anodisk tDCS som ensidig M1 stimulering med anoden plassert på M1 av interesse og katoden plassert på motsatt pannen; den grunnleggende ideen om denne tilnærmingen er oppregulering av oppstemthet i M1 av interesse 6,13,19 – 22; 2) anodisk tDCS som bilateral M1 stimulering (også referert til som "bihemispheric" eller "dual" stimulering) med anoden plassert på M1 av interesse og katoden plassert på den kontralaterale M1 5,6,14,23,24; den grunnleggende ideen om denne tilnærmingen er å maksimere stimulering fordelene ved oppregulering av oppstemthet i M1 av interesse mens downregulating oppstemthet i motsatt M1 (dvs. modulering av interhemispheric hemming mellom de to M1S); 3) For Ovfø, har bare den ovennevnte ensidig M1 stimulering montage vært investigrerte 4,6; med denne montage eksitabilitet fremmende effekter av TRNS er funnet for frekvensspekteret av 100-640 Hz fire. Valget av hjernestimulering strategi og elektrodemontasje representerer et kritisk punkt for en effektiv og pålitelig bruk av NEBS i kliniske eller forsknings innstillinger. Her disse tre Nebs prosedyrene er beskrevet i detalj som brukes i menneskelige motor systemstudier og metodiske og begrepsmessige aspekter blir diskutert. Materialer for unilaterale eller bilaterale tDCS og ensidige Ovfø er de samme (figur 2).
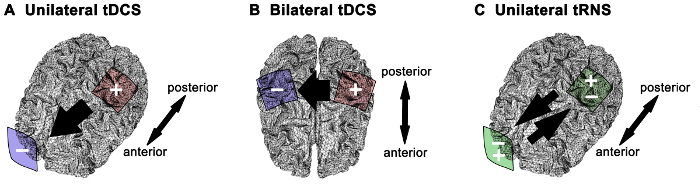
Figur 1. Elektrode montasjer og strømretningen for forskjellige Nebs strategier. (A) For ensidig anodisk transkranial likestrøm stimulering (tDCS) er anoden sentrert over den primære motor cortex av interesse og katoden plassert over than Kontralateralt supra-orbital området. (B) For bilateral motor cortex stimulering, anode og katode er plassert hver over en motor cortex. Plasseringen av anoden bestemmer motor cortex av interesse for anodisk tDCS. (C) For ensidig transkranial tilfeldig støy stimulering (TRNS) blir en elektrode plassert over motoren cortex og den andre elektrode over motsatt supra-orbital område. Av strømmen som føres mellom elektrodene er indikert med sorte pil. Anode (+, red), katode (-, blå), Vekselstrøm (+/-, grønn). Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Denne protokollen beskriver typiske materialer og prosessuelle skritt for modulering av hånden motorikk og ferdigheter læring ved hjelp NEBS, spesielt unilateral og bilateral M1 stimulering for anodisk tDCS, og ensidige Ovfø. Før du velger en bestemt NEBS protokoll for et menneske motor system studie, f.eks., I sammenheng med motorisk læring, metodiske aspekter (sikkerhet, toleranse, blinding) samt konseptuelle aspekter (montasje eller strømtype spesifikke effekter på en bestemt hjerneregion) må tas i b…
Divulgations
The authors have nothing to disclose.
Acknowledgements
MC og JR er støttet av den tyske Research Foundation (DFG RE 2740 / 3-1).
Materials
| NEBS device (DC Stimulator plus) | Neuroconn | ||
| Electrode cables | Neuroconn | ||
| Conductive-rubber electrodes | Neuroconn | 5×5 cm | |
| Perforated sponge bags | Neuroconn | 5×5 cm | |
| Non-conductive rubber sponge cover | Amrex-Zetron | FG-02-A103 | Rubber pad 3"*3" |
| NaCl isotonic solution | B. Braun Melsungen AG | A1151 | Ecoflac, 0,9% |
| Cotton crepe bandage | Paul Hartmann AG | 931004 | 8x5m, textile elasticity |
| Adhesive tape (Leukofix) | BSN medical | 02122-00 | 2,5cm*5m |
| Skin preparation paste | Weaver | 10-30 | |
| Magnetic stimulator | Magstim | 3010-00 | Magstim 200 |
| EMG conductive paste | GE Medical Systems | 217083 | |
| EMG bipolar electrodes | e.g., Natus Medical Inc. Viking 4 | ||
| EMG amplifier | e.g., Natus Medical Inc. Viking 4 | ||
| Cable for EMG signal transmission | e.g., Natus Medical Inc. Viking 4 | ||
| Data acquisition unit | Cambridge Electronic Design (CED) | MK1401-3 | AD converter |
| Computer for signal recording and offline analysis | |||
| Signal 4.0.9 | Cambridge Electronic Design (CED) | Software | |
| non-permanent skin marker | Edding | 8020 | 1 mm, blue |
References
- Reis, J., Fritsch, B. Modulation of motor performance and motor learning by transcranial direct current stimulation. Curr Opin Neurol. 24 (6), 590-596 (2011).
- Nitsche, M., Paulus, W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol. 527 (3), 633-639 (2000).
- Nitsche, M. A., Cohen, L. G., et al. Transcranial direct current stimulation: State of the art. Brain Stimul. 1 (3), 206-223 (2008).
- Terney, D., Chaieb, L., Moliadze, V., Antal, A., Paulus, W. Increasing human brain excitability by transcranial high-frequency random noise stimulation. J Neurosci. 28 (52), 14147-14155 (2008).
- Kidgell, D. J., Goodwill, A. M., Frazer, A. K., Daly, R. M. Induction of cortical plasticity and improved motor performance following unilateral and bilateral transcranial direct current stimulation of the primary motor cortex. BMC Neurosci. 14 (1), 64 (2013).
- Prichard, G., Weiller, C., Fritsch, B., Reis, J. Brain Stimulation Effects of Different Electrical Brain Stimulation Protocols on Subcomponents of Motor Skill Learning. Brain Stimul. 7 (4), 532-540 (2014).
- Antal, A., Paulus, W., Hunter, M. A. Transcranial alternating current stimulation ( tACS ). Front Hum Neurosci. 7, 1-4 (2013).
- Collins, J. J., Chow, C. C., Imhoff, T. T. Stochastic resonance without tuning. Nature. 376 (6537), 236-238 (1995).
- Miniussi, C., Harris, J. A., Ruzzoli, M. Modelling non-invasive brain stimulation in cognitive neuroscience. Neurosci Biobehav Rev. 37 (8), 1702-1712 (2013).
- Bindman, L. J., Lippold, O. C., Redfearn, J. W. the Action of Brief Polarizing Currents on the Cerebral Cortex of the Rat (1) During Current Flow and (2) in the Production of Long-Lasting After-Effects. J Physiol. 172, 369-382 (1964).
- Fritsch, B., Reis, J., et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: Potential implications for motor learning. Neuron. 66 (2), 198-204 (2010).
- Galea, J. M., Celnik, P. Brain polarization enhances the formation and retention of motor memories. J Neurophysiol. 102 (1), 294-301 (2009).
- Reis, J., Fischer, J. T., Prichard, G., Weiller, C., Cohen, L. G., Fritsch, B. Time- but Not Sleep-Dependent Consolidation of tDCS-Enhanced Visuomotor Skills. Cereb Cortex. (1), 1-9 (2013).
- Saiote, C., Turi, Z., Paulus, W., Antal, A. Combining functional magnetic resonance imaging with transcranial electrical stimulation. Front Hum Neurosci. 7 (8), 435 (2013).
- Sehm, B., Kipping, J., Schäfer, A., Villringer, A., Ragert, P. A Comparison between Uni- and Bilateral tDCS Effects on Functional Connectivity of the Human Motor Cortex. Front Hum Neurosci Neurosci. 7 (4), 183 (2013).
- Moliadze, V., Antal, A., Paulus, W. Electrode-distance dependent after-effects of transcranial direct and random noise stimulation with extracephalic reference electrodes. Clin Neurophysiol. 121 (12), 2165-2171 (2010).
- Bikson, M., Rahman, a., Datta, a. Computational Models of Transcranial Direct Current Stimulation. Clin EEG Neurosci. 43 (3), 176-183 (2012).
- Opitz, A., Paulus, W., Will, A., Thielscher, A. Determinants of the electric field during transcranial direct current stimulation. Neuroimage. 109, 140-150 (2015).
- Nitsche, M., Paulus, W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 57 (10), 1899-1901 (2001).
- Reis, J., Schambra, H. M., et al. Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. Proc Natl Acad Sci U S A. 106 (5), 1590-1595 (2009).
- Batsikadze, G., Moliadze, V., Paulus, W., Kuo, M. -. F., Nitsche, M. a Partially non-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans. J Physiol. 591 (7), 1987-2000 (2013).
- Wiethoff, S., Hamada, M., Rothwell, J. C. Variability in response to transcranial direct current stimulation of the motor cortex. Brain Stimul. 7 (3), 468-475 (2014).
- Mordillo-Mateos, L., Turpin-Fenoll, L., et al. Effects of simultaneous bilateral tDCS of the human motor cortex. Brain Stimul. 5 (3), 214-222 (2012).
- Tazoe, T., Endoh, T., Kitamura, T., Ogata, T. Polarity Specific Effects of Transcranial Direct Current Stimulation on Interhemispheric Inhibition. PLoS One. 9 (12), e114244 (2014).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clin Neurophysiol. 112, 720 (2000).
- Villamar, M. F., Volz, M. S., Bikson, M., Datta, A., Dasilva, A. F., Fregni, F. Technique and considerations in the use of 4×1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309 (2013).
- Brasil-Neto, J. P., Cohen, L. G., Panizza, M., Nilsson, J., Roth, B. J., Hallett, M. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J Clin Neurophysiol. 9 (1), 132-136 (1992).
- Mills, K., Boniface, S., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalogr Clin Neurophysiol. 85 (1), 17-21 (1992).
- Rothwell, J., Hallett, M., Berardelli, A., Eisen, A., Rossini, P., Paulus, W. Magnetic stimulation motor evoked potentials. Electroencephalogr Clin Neurophysiol Suppl. 52, 97-103 (1999).
- Ueno, S., Tashiro, T., Harada, K. Localized stimulation of neural tissues in the brain by means of a paired configuration of time-varying magnetic fields. J Appl Phys. 64 (10), 5862-5864 (1988).
- Fleming, M. K., Sorinola, I. O., Newham, D. J., Roberts-Lewis, S. F., Bergmann, J. H. M. The effect of coil type and navigation on the reliability of transcranial magnetic stimulation. IEEE Trans Neural Syst Rehabil Eng. 20 (5), 617-625 (2012).
- Brunoni, A. R., Amadera, J., Berbel, B., Volz, M. S., Rizzerio, B. G., Fregni, F. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int J Neuropsychopharmacol. 14 (8), 1133-1145 (2011).
- Palm, U., Reisinger, E., et al. Brain Stimulation Evaluation of Sham Transcranial Direct Current Stimulation for Randomized, Placebo-Controlled Clinical Trials. Brain Stimul. 6 (4), 690-695 (2013).
- Sehm, B., Schäfer, A., et al. Dynamic modulation of intrinsic functional connectivity by transcranial direct current stimulation. J Neurophysiol. 108 (12), 3253-3263 (2012).
- Nitsche, M. A., Schauenburg, A., et al. Facilitation of implicit motor learning by weak transcranial direct current stimulation of the primary motor cortex in the human. J Cogn Neurosci. 15 (4), 619-626 (2003).
- Antal, A., Begemeier, S., Nitsche, M. A., Paulus, W. Prior state of cortical activity influences subsequent practicing of a visuomotor coordination task. Neuropsychologia. 46 (13), 3157-3161 (2008).
- Kang, E. K., Paik, N. J. Effect of a tDCS electrode montage on implicit motor sequence learning in healthy subjects. Exp Transl Stroke Med. 3 (1), 4 (2011).
- Kantak, S. S., Mummidisetty, C. K., Stinear, J. W. Primary motor and premotor cortex in implicit sequence learning – Evidence for competition between implicit and explicit human motor memory systems. Eur J Neurosci. 36 (5), 2710-2715 (2012).
- Nissen, M. J., Bullemer, P. Attentional requirements of learning: Evidence from performance measures. Cogn Psychol. 19 (1), 1-32 (1987).
- Stagg, C. J., Jayaram, G., Pastor, D., Kincses, Z. T., Matthews, P. M., Johansen-berg, H. Polarity and timing-dependent effects of transcranial direct current stimulation in explicit motor learning. Neuropsychologia. 49 (5), 800-804 (2011).
- Poreisz, C., Boros, K., Antal, A., Paulus, W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res Bull. 72 (4-6), 208-214 (2007).
- Gandiga, P. C., Hummel, F. C., Cohen, L. G. Transcranial DC stimulation (tDCS): a tool for double-blind sham-controlled clinical studies in brain stimulation. Clin Neurophysiol. 117 (4), 845-850 (2006).
- Baudewig, J., Nitsche, M. A., Paulus, W., Frahm, J. Regional modulation of BOLD MRI responses to human sensorimotor activation by transcranial direct current stimulation. Magn Reson Med. 45 (2), 196-201 (2001).
- Venkatakrishnan, A., Sandrini, M. Combining transcranial direct current stimulation and neuroimaging: novel insights in understanding neuroplasticity. J Neurophysiol. 107 (1), 1-4 (2012).
- Neuling, T., Wagner, S., Wolters, C. H., Zaehle, T., Herrmann, C. S. Finite-element model predicts current density distribution for clinical applications of tDCS and tACS. Frontiers in Psychiatry. 3, 1-10 (2012).
- Bikson, M., Rahman, A. Origins of specificity during tDCS anatomical, activity-selective, and input-bias mechanisms. Front Hum Neurosci. 7, 1-5 (2013).
- Truong, D. Q., Hüber, M., et al. Brain Stimulation Clinician Accessible Tools for GUI Computational Models of Transcranial Electrical Stimulation BONSAI and SPHERES. Brain Stimul. 7 (4), 521-524 (2014).
- Caparelli-Daquer, E. M., Zimmermann, T. J., et al. A Pilot Study on Effects of 4×1 High-Definition tDCS on Motor Cortex Excitability. Proc Annu Int Conf IEEE Eng Med Biol Soc EMBS. , 735-738 (2012).
- Kuo, H. I., Bikson, M., et al. Comparing cortical plasticity induced by conventional and high-definition 4 x 1 ring tDCS: A neurophysiological study. Brain Stimul. 6 (4), 644-648 (2013).

