Dissolução dinâmico Nuclear Polarização Instrumentação para em tempo real enzimática Reaction Taxa de Medições por RMN
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
A principal limitação de investigações baseados-RMN é baixa sensibilidade. Isso leva para tempos de aquisição longos, evitando assim que as medições de RMN em tempo real de transformações metabólicas. Hiperpolarização através de dissolução DNP contorna parte da sensibilidade emite graças ao grande magnetização nuclear fora de equilíbrio decorrente da transferência de spin polarização de elétrons-to-núcleo. O sinal de RMN de alta obtido pode ser utilizado para monitorizar as reacções químicas em tempo real. A desvantagem de RMN hiperpolarizado reside na janela de tempo limitado disponível para a aquisição de sinal, o qual é geralmente da ordem de spin nuclear longitudinal constante tempo de relaxamento, T1, ou, em casos favoráveis, a fim de a constante de tempo de relaxação associada com a camisola de estado de núcleos acoplados, T LLS. captação celular de moléculas endógenas e taxas metabólicas podem fornecer informações essenciais sobre o desenvolvimento do tumor e resposta à droga. Nuestudos de RMN hiperpolarizados anteriores merosas demonstraram a relevância do piruvato como substrato metabólico para monitorar a atividade enzimática in vivo. Este trabalho apresenta uma descrição detalhada da instalação experimental e métodos necessários para o estudo de reacções enzimáticas, em particular a taxa de piruvato-a-lactato de conversão na presença de lactato desidrogenase (LDH), por RMN hiperpolarizado.
Introduction
Polarização nuclear dinâmica (DNP), 1,2 uma técnica destinada a reforçar a polarização do spin nuclear, ou seja, o desequilíbrio entre 'up' e populações de spin "para baixo" (P = [N ↑ – N ↓] / [N ↑ + N ↓]), foi introduzido pela primeira vez na década de 1950. Spins nucleares, tais como 13 C pode ser polarizado até P = 10 -1 em condições favoráveis, tipicamente a uma temperatura da ordem de 1 K e no um campo magnético de 3,4 3,357 T. Uma descoberta para aplicações biológicas no veio início dos anos 2000 com o desenvolvimento de dissolução DNP que consiste em dissolver amostras polarizado congelado em água sobreaquecida, mantendo o alto nível de polarização nuclear obtido a baixa temperatura. 5 o sinal de NMR líquido-estado é aumentada por um factor de 10 3 -10 4, em comparação com comumtermicamente polarizada condições RT RMN. Portanto dissolução DNP fornece uma maneira de medir bioquímica taxas de reação não-invasiva in situ em tempo real, permitindo que a dinâmica de monitoramento por RMN com uma resolução temporal de 1 segundo ou menos 6 -. 10 Tornou-se também possível detectar analitos em concentrações muito baixas 11.
Entre as modalidades de imagens moleculares não-invasivos, hiperpolarizado RMN é a única técnica que permite a medição em simultâneo de um substrato e os seus produtos metabólicos em tempo real. Dissolução DNP foi recebida com entusiasmo em vários domínios científicos que variam de RMN in vitro a 12 de IRM clínica e as aplicações mais promissores estão relacionados com a monitorização in situ de metabolismo. 13,14 A principal limitação da dissolução DNP é que, depois de um tempo a fim de cinco vezes o tempo de relaxamento longitudinal constante T 1, o reforçada polarzação está perdido. Por conseguinte, é necessário o uso de moléculas de rolamento spins nucleares apresentem relativamente longo T 1. Para estender o período de tempo do realce polarização, lentamente-relaxante estados de spin nuclear, conhecidos como estados durabilidade (LLS), pode ser usado 15 -. 17 LLS são insensíveis ao intra-par interacção dipolo-dipolo, pelo que a sua tempo de relaxamento característico constante, t LLS, pode ser muito mais longo do que T 1. 18 Uma vida magnetização de dezenas de minutos e até 1 hora poderia, portanto, ser obtido, e 19,20 LLS têm sido propostos para ambos espectroscopia de ressonância magnética (MRS) e ressonância magnética. 21
Os principais pontos que necessitam de ser cuidadosamente optimizadas, para estudar as taxas de reacção enzimática por RMN hiperpolarizado são: (i) maximizar a polarização em estado sólido e (ii) minimizar a perda de polarização durante a transferência da solução do hiperpolarizadopolarizador para o espectrómetro de RMN. Este artigo descreve a adaptação de uma dissolução aparelhos e injeção sistema DNP feitos sob medida para estudar reações enzimáticas. As características eo desempenho da configuração será demonstrado com o substrato hyperpolarized bem conhecido e amplamente utilizado [1- 13 C] piruvato. As principais razões para esta escolha são, em primeiro lugar, o seu naturalmente longa C tempo de 13 relaxamento longitudinal (T 1> 50 seg a altos campos magnéticos e temperaturas acima de 293 K), que permite reações de monitorização durante vários minutos, e, em segundo lugar, o seu papel central na cancro do metabolismo. 13,14 Usando dissolução DNP RMN e um sistema de injecção sob medida desenvolvido, a oxidação de piruvato catalisada pela lactato desidrogenase (LDH) pode ser monitorizado na presença de um conjunto inicial de lactato não marcado ou 9,22 sem lactato não marcada adicionada , como mostrado aqui. Tem sido demonstrado que a [1- 13 C] lactato sinal medido no viVO (incluindo em células) após a injecção de hiperpolarizado [1- 13 C] piruvato é principalmente devido a uma troca rápida entre etiqueta e piruvato de lactato em vez do que a produção de lactato. 6
Nós apresentamos aqui a produção em tempo real de lactato [1- 13 C] a partir de piruvato hiperpolarizado [1- 13 C] injectada num tubo de RMN contendo LDH, mas inicialmente não lactato.
Descrição do sistema
Há duas partes principais em uma configuração de dissolução DNP (Figura 1): O polarizador DNP eo espectrômetro NMR. O elemento principal do polarizador DNP é um criostato para arrefecer a amostra a cerca de 1 K em um banho de hélio bombeado. O criostato é inserido em um magneto supercondutor 3,35 T e tem uma geometria que garante a ter a amostra de polarização no isocentro do íman (Figura 1). Dentro do criostato, a amostra (a) está rodeado por uma bobina de RMN (b), para medir a polarização buildup, contido numa cavidade de microondas overmoded (c). A totalidade da amostra é mantida a baixa temperatura num banho de hélio bombeado (d) e irradiada com micro-ondas através do guia de ondas. Todo o sistema é gerido pelo software feito sob medida (Figura 2D).
O hardware e equipamentos criogênicos necessários para realizar DNP ea subsequente dissolução ainda são um desafio tecnológico. Um novo DNP criostato 23,24 foi desenvolvido e testado para determinar suas performances criogénicos e otimizado para rápido esfriamento, hélio-tempo de espera e do consumo global de hélio mínima durante a operação.
O criostato consiste em duas partes. A primeira parte do criostato é o Dewar isolamento (Figura 2A) que pode ser mais ou menos separados na parte superior (A) da cauda, ou espaço de amostra (b), e a câmara de vácuo exterior (OCV) mantido sob alto vácuo e abrigando o telas de radiação (c). A segunda parte do criostato é o principalsert (Figura 2B), colocado no vaso Dewar de isolamento, em que todas as normas de fluxo são administrados. O hélio líquido proveniente do vaso Dewar de armazenamento externo através da linha de transferência (A), é, na primeira fase condensada no separador (b), uma câmara intermediária utilizado tanto para manter a parte superior do frio criostato e para remover o hélio evaporado durante a transferência. A pressão do separador é reduzido por bombeamento através de um capilar (c) envolvida em torno da parte superior do criostato; o fluxo de hélio frio nesta capilar é usada para arrefecer os defletores (d) e as telas de radiação na dewar isolamento (OVC). A amostra é colocada e polarizado no espaço de amostra. O espaço de amostra está conectado ao separador através de um outro capilar (e), enrolado em torno da cauda do inserto principal criostato. Esta capilaridade pode ser aberta ou fechada através de uma válvula de agulha operado manualmente a partir do exterior.
Para conseguir a baixa temperatura utilizada durante o pr DNPocesso, hélio líquido precisa ser recolhido no espaço amostral criostato e sua pressão baixou para o intervalo mbar. As operações necessárias para a operação criostato são realizados através de um sistema de bombeamento bastante complexo com três conjuntos de bombas, monitoradas e operadas em diferentes pontos com instrumentos eletrônicos e eletro-mecânico (Figura 2C). O criostato COV tem de ser bombeado a vácuo elevado por o primeiro sistema de bombeamento. Este sistema é composto de uma bomba de turbo-molecular apoiado por uma bomba rotativa (a). O hélio líquido é transferido do vaso Dewar de armazenamento (b), através da entrada de linha de transferência de criostato para o separador de criostato. O separador tem uma saída ligada ao segundo conjunto de bombagem. Este conjunto é constituído por uma bomba de membrana / h 35 m 3 (c). Esta linha permite a remoção do gás hélio fervida durante a transferência do dewar e durante o arrefecimento separador. O hélio líquido recolhido no separador pode então ser transferido para o espaço da amostra através do tampãoIllary tubos descrito acima. Para transferir o hélio líquido do separador para o espaço de amostra e, posteriormente, a pressão do espaço de amostra inferior para mbar gama, um terceiro sistema de bombagem composto por uma de 250 m 3 / hr Raízes bomba apoiada por um / h bomba rotativa 65 m 3 (d) está ligado à criostato através de uma válvula de borboleta Manual (e).
Todas as operações do sistema de vácuo são controlados e regulados por um dispositivo feito sob medida eletropneumático (f). Este dispositivo controla as conexões de linha de vácuo entre o separador de criostato (g) e espaço de amostra (h) de escoamento, o segundo sistemas de bombagem / terceiros (c, d), uma garrafa de hélio comprimido (i) e o lado de fora. A comunicação entre (f) e o exterior passa através de uma válvula de uma via (J). O dispositivo de electro-pneumática (f), bem como todos os parâmetros do sistema e o hardware dissolução são controlados e operados por um dispositivo de interface USB electrónico feito por medida com um PC comum. Finalmente todo o sistema, através da electrónicadispositivo, é gerido pelo software independente feito por encomenda (Figura 2D) onde as operações relevantes são lançados através de uma interface utilizando os botões de software.
Para gerenciar a amostra e medir RMN sinal de build-up no estado sólido de uma série de inserções são usadas (Figura 3A). Para preparar o criostato para a polarização, colocar o inserto amostra principal (a), no criostato. O principal inserção de amostra é proporcionado com uma bobina de RMN (b) colocada dentro de uma cavidade de microondas overmoded banhados a ouro. Pré-congelamento do substrato que contém a solução a ser polarizada (solução de polarização) à temperatura do azoto líquido num recipiente de amostras adequado e colocá-la na extremidade inferior do suporte de amostra de fibra de vidro (C). Deslize o porta-amostras para a principal inserção amostra para chegar ao isocentro ímã. Insira o guia de ondas banhado a ouro (d) no porta-amostras. O guia de onda permite que o micro-ondas geradas a partir de uma fonte externa de microondas para viajar com perdas mínimas to da amostra.
O software feito sob medida para a gestão criostato trata automaticamente, após clicar no botão de interface correspondente, diferentes operações como cooldown (a temperatura criostato é abaixado perto de temperatura hélio líquido), enchendo (criostato é preenchido com hélio líquido para um nível pré-determinado ), uma etapa adicional de arrefecimento para T ≈ 1 K (o banho de hélio líquido é bombeado para atingir a temperatura mais baixa possível), pressurização (criostato é pressurizado ligeiramente acima da pressão ambiente em P = 30/10 mbar para permitir a abertura criostato sem riscos de contaminação do ar por criostato) e dissolução (procedimento automático para dissolver a amostra DNP e transferir a solução resultante hiperpolarizado para o local de medição, isto é, o espectrómetro de RMN).
A polarização é realizada irradiando a amostra com microondas a 94 GHz (em um campo de polarização B 0 </sub> = 3.35 T). Uma amostra é considerada completamente polarizada após 3 t DNP, onde T é o tempo de DNP polarização incrustações. T DNP é da mesma ordem de grandeza que o tempo de relaxamento longitudinal dos núcleos alvo no estado sólido à temperatura e o campo dado. Em todas as nossas experiências, a amostra foi polarizado por mais de 5 t DNP.
No final do tempo de polarização, a amostra tem que ser dissolvido numa solução de RT, a fim de ser utilizado para a medição da actividade enzimática. Durante o processo de dissolução, 5 ml de sobreaquecido D 2 O a partir da caldeira da inserção de dissolução (Figura 3B) são empurrados por hélio gasoso comprimido (P = 6-8 bar) para atingir a amostra de DNP-reforçada e dissolvê-lo. A solução resultante hiperpolarizado é empurrada para fora o inserto de dissolução pelo gás de hélio comprimido, através da saída de dissolução de inserção (Figura 3C-b </strong>), um diâmetro interior do tubo de transferência Teflon 2 mm. O tempo necessário para o processo de dissolução é 300 mseg. 23 O tempo necessário para a transferência de amostras do polarizador DNP para o local espectrómetro de RMN é de cerca de 3 segundos.
O processo de dissolução é realizado utilizando uma inserção de dissolução (Figura 3B). A inserção de dissolução é composto por um conjunto electrónico, pneumático (a), uma vara de fibra de carbono (b) contendo tubos de ligação entre a caldeira na montagem de pneumático e o armário recipiente da amostra (C), que permite o acoplamento estanque com a amostra recipiente, e de volta para a saída. O conjunto de electro-pneumática (Figura 3C) é utilizada para produzir e dirigir sobreaquecido D 2 O através da vara de fibra de carbono para o recipiente de amostra e, em seguida, para extrair a solução hiperpolarizado do criostato. O conjunto de electro-pneumático é composto por válvulas pneumáticas (A), que controlam a ligação entre o cohélio mpressed (P = 6-8 bar) linha (b), a caldeira (C), onde a D 2 O é injectado através da válvula (d), e a saída (e) através da vara de fibra de carbono (f). O sistema é completado por um G pressão, um termómetro e um fio resistivo de aquecimento no interior da caldeira (c), um gatilho (h) e uma caixa de ligação (i) utilizados para fazer a interface com o sistema do dispositivo de gestão electrónica.
O criostato DNP e o espectrómetro de RMN estão ligados por uma linha de transferência, ou seja, um tubo de PTFE de 2 mm de diâmetro interno no interior do qual a solução hiperpolarizado é arrastada por hélio pressurizado (P = 6-8 bar), quando a dissolução é disparado.
A sequência de dissolução é composto das seguintes operações: em os primeiros 300 ms, sobreaquecido D 2 S é empurrado para o recipiente da amostra, a fim de fundir e dissolver a solução congelada hiperpolarizado. Em seguida, a solução é extraída hiperpolarizado do criostato por meio de pressurized (P = 6-8 bar) de gás hélio e empurrado através do tubo de PTFE diâmetro interno de 2 mm (Figura 3C-E) para o local de medição, onde a injecção é realizada com qualquer um dos procedimentos descritos no passo 6.2.1 ou 6.2 Passo .2.
O segundo componente da dissolução configuração DNP RMN é o espectrómetro de RMN. Na configuração aqui descrita, o espectrómetro de RMN opera em um campo B 0 = 11,7 Tesla. Uma sonda de RMN de 5 milímetros é utilizado para medir o sinal de hiperpolarizado, após a dissolução. O espectrômetro NMR é operado através do console RMN, utilizado tanto para solid-state e líquidos estatais medições de RMN, eo XWinNMR software fornecido pelo empresa. Uma medida típico é composto de um pulso dura baixo ângulo flip (seja calibrado, por liquidstate ou não-calibrados, para medições de estado sólido), seguido de aquisições de sinal.
As medições do sinal de polarização térmico de estado sólido Si e DNP-derivadonal acumulação são realizadas utilizando a bobina feito por encomenda 13 C no local do polarizador DNP (Figura 3ab) acoplado ao espectrómetro de RMN. Nesta situação particular, o espectrômetro de RMN não executa bloqueio de sinal. Quando as medições de estado sólido são levadas a cabo, a fim de evitar perturbações significativas para a polarização, o atraso de tempo entre aquisições deve ser suficientemente longo, mais do que cerca de 0,5 t de DNP.
O realce de estado sólido é definida como 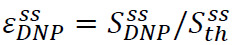 Onde
Onde ![]() é o sinal hiperpolarizado (obtido no Passo 3.3) e
é o sinal hiperpolarizado (obtido no Passo 3.3) e ![]() é o sinal de estado sólido (obtido em equilíbrio térmico à temperatura de hélio líquido bombeado no Passo 3.2) (Figura 4A). Este parâmetro defines a polarização máxima disponível para experiências de RMN, antes de as perdas inevitáveis durante a transferência da solução hiperpolarizado. A medição é realizada com uma sequência de pulsos-acquire simples, usando um pulso de baixo ângulo aleta un-calibrado. calibração de pulso é comumente ignorada para medições Solidstate.
é o sinal de estado sólido (obtido em equilíbrio térmico à temperatura de hélio líquido bombeado no Passo 3.2) (Figura 4A). Este parâmetro defines a polarização máxima disponível para experiências de RMN, antes de as perdas inevitáveis durante a transferência da solução hiperpolarizado. A medição é realizada com uma sequência de pulsos-acquire simples, usando um pulso de baixo ângulo aleta un-calibrado. calibração de pulso é comumente ignorada para medições Solidstate.
Um procedimento análogo pode ser utilizado para determinar o aumento do sinal hiperpolarizado no líquido-estado. Neste caso, a amostra deve ser colocada no tubo de espectrómetro antes da injecção (Passo 6.2) é composto por 500 ul de D 2 O. Após a dissolução e injeção, existem dois parâmetros importantes para monitorar. O primeiro é a melhoria hiperpolarizado no local espectrómetro de RMN, 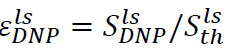 (Figura 4B), onde
(Figura 4B), onde ![]() é apenas o sinal após a injecção da hiper solução polarizada (obtido no Passo 7.1) e
é apenas o sinal após a injecção da hiper solução polarizada (obtido no Passo 7.1) e ![]() é o sinal de polarização térmica (obtido no Passo 7.2). O segundo é o tempo de relaxamento longitudinal, T 1 (Figura 4B, inserir), associada com o substrato e cada produto metabólico (obtido por sinais exponenciais montagem obtido no Passo 7.1). Estes dois parâmetros definem a concentração mínima do substrato necessário para se obter uma proporção suficiente de sinal-para-ruído (SNR) e a janela de tempo disponível para a medição das transformações metabólicas. A relação entre a polarização em estado sólido
é o sinal de polarização térmica (obtido no Passo 7.2). O segundo é o tempo de relaxamento longitudinal, T 1 (Figura 4B, inserir), associada com o substrato e cada produto metabólico (obtido por sinais exponenciais montagem obtido no Passo 7.1). Estes dois parâmetros definem a concentração mínima do substrato necessário para se obter uma proporção suficiente de sinal-para-ruído (SNR) e a janela de tempo disponível para a medição das transformações metabólicas. A relação entre a polarização em estado sólido ![]() e polarização liquidstate
e polarização liquidstate ![]() dá uma estimativa das perdas de polarização devido ao relaxamento durante a transferência solução hiperpolarizado. Um valoration12 "src =" files / ftp_upload / 53548 / 53548equation12.jpg "width =" / 80 "/> deve ser observado na ausência de perdas de relaxamento.
dá uma estimativa das perdas de polarização devido ao relaxamento durante a transferência solução hiperpolarizado. Um valoration12 "src =" files / ftp_upload / 53548 / 53548equation12.jpg "width =" / 80 "/> deve ser observado na ausência de perdas de relaxamento.
Protocol
Representative Results
Discussion
Os pontos críticos da dissolução experimento DNP RMN são: (i) o nível de polarização atingida para o substrato, o qual determina a concentração mais baixa do produto necessário para experiências, bem como o número de aquisições de sinal que podem ser realizadas e (ii) os tempos de vida de magnetização, em comparação com a duração da transferência entre a polarização e os locais de detecção e para a taxa de transformação do substrato. O sistema de injecção da configuração DNP dissolução a…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Os autores agradecem o Dr. JJ van der Klink para a assistência na escolha e montagem dos equipamentos, bem como o Dr. F. Kateb e Dr. G. Bertho para discussões úteis. AC foi apoiado pela Swiss National Science Foundation (conceder PPOOP2_157547). Nós reconhecemos o financiamento de Paris Sorbonne Cité (RMN @ Com, DIM Analytics, Ville de Paris, a Fondation de la Recherche Médicale (FRM ING20130526708), eo Parteneriat Hubert Curien Brancusi 32662QK. Nossa equipe é parte de programas Equipex Paris-en-ressonância e CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
References
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

