Imaging potenziale di membrana con due tipi di geneticamente codificati fluorescenti di sensori di tensione
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
Il principale obiettivo di questo lavoro è quello di dimostrare l'imaging ottico delle variazioni di potenziali di membrana in vitro utilizzando proteine fluorescenti geneticamente codificate. cambiamenti di imaging del potenziale di membrana offre l'eccitante possibilità di studiare l'attività dei circuiti neuronali. Quando i cambiamenti nella membrana risultato potenziale in un cambiamento intensità di fluorescenza, ogni pixel della telecamera diventa un elettrodo surrogata per misure non intrusivi di attività neuronale. Da oltre quarant'anni, coloranti organici voltaggio-sensibile sono stati utili per osservare i cambiamenti nel potenziale di membrana 1-4. Tuttavia, questi coloranti mancano di specificità cellulare. Inoltre, alcuni tipi di cellule sono difficili da macchiare. indicatori di tensione geneticamente codificati (GeViS) superare queste limitazioni avendo le cellule da studiare specificamente esprimono la sonda fluorescente tensione-sensibili.
Ci sono tre classi di Gevis. La prima classe di GEVI utilizza il vodominio della fosfatasi tensione-sensing ensione-sensing con una singola proteina fluorescente (FP) 5-9 o un paio 10-12 un Förster trasferimento di energia di risonanza (FRET). La seconda classe di sensori utilizza microbica rodopsina come indicatore fluorescente direttamente 13-15 o tramite FRET elettrocromico 16,17. La terza classe utilizza due componenti, il componente genetica essendo un FP membrana ancorata ed un secondo componente essendo una membrana vincolato tempra colorante 18-20. Mentre il secondo e terzo classi sono utili per esperimenti in vitro e fetta 19,20, solo la prima classe di sensori sono attualmente utile per analisi in vivo 6.
In questo rapporto ci sarà dimostrare l'imaging del potenziale di membrana utilizzando la prima classe di Gevis (figura 1) in vitro. Questa prima classe di sensori di tensione è il più facile da passare a imaging in vivo. Dal momento che Gevis utilizing un dominio di rilevamento della tensione fuso ad una FP sono circa 50 volte più luminoso classe rodopsina dei sensori, possono essere ripreso con illuminazione lampada ad arco anziché richiedere un laser estremamente potente. Un'altra conseguenza della disparità di luminosità è che la prima classe di GeViS può facilmente superare l'auto-fluorescenza del cervello. Le sonde rodopsina-based non può. La terza classe di sensore è altrettanto chiaro come la prima classe, ma richiede l'aggiunta di un quencher chimico che è difficile da gestire in vivo.
Noi, quindi, dimostrare l'acquisizione di una sonda con un singolo FP (Bongwoori) 8 e una sonda costituita da una coppia FRET (Nabi 2) 12. Il FRET costruisce in questo rapporto sono versioni farfalla di VSFP-CR (proteine fluorescenti voltaggio-sensibile – Clover-mRuby2) 11 costituito da un donatore fluorescente verde, trifoglio, e un accettore fluorescente rossa, mRuby2, chiamato Nabi 2.242 e 2.244 Nabi <sup> 12. L'introduzione di questi tipi di registrazioni dovrebbe dare ai ricercatori una migliore comprensione del tipo di Gevis di informazione in grado di fornire.
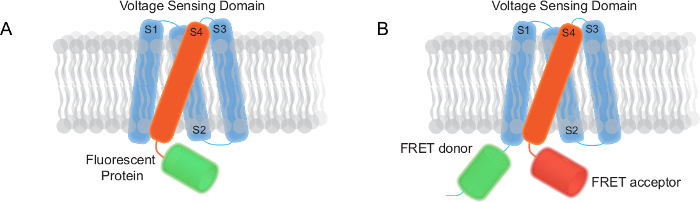
Figura 1. due tipi di indicatori geneticamente codificati tensione (Gevis) Divisori stampati in questo rapporto (A) Un FP mono basato GEVI avere un dominio di tensione-sensing trans-membrana e una proteina fluorescente. (B) Un GEVI basato FRET composto da un dominio di tensione-sensing trans-membrana, un donatore tasto e accettore. Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
Il sistema nervoso utilizza tensione in diversi modi, inibizione provoca un leggero iperpolarizzazione, ingresso sinaptica provoca un leggero depolarizzazione e un'azione potenziali risultati in un cambiamento relativamente grande tensione. La possibilità di misurare le variazioni del potenziale di membrana dalla Gevis offre il potenziale promettente di analizzare diversi componenti di circuiti neuronali contemporaneamente. In questo rapporto si dimostra un metodo fondamentale per le modifiche di imaging del potenz…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
References
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

