בידוד תאי גזע זקיק שיער עוריות קרטינוציטים מן עור עכבר הגבה
Summary
An ideal model for studying adult stem cell biology is the mouse hair follicle. Here we present a protocol for isolating different populations of hair follicles stem cells and epidermal keratinocytes, employing enzymatic digestion of mouse dorsal skin followed by FACS analysis.
Abstract
The hair follicle (HF) is an ideal system for studying the biology and regulation of adult stem cells (SCs). This dynamic mini organ is replenished by distinct pools of SCs, which are located in the permanent portion of the HF, a region known as the bulge. These multipotent bulge SCs were initially identified as slow cycling label retaining cells; however, their isolation has been made feasible after identification of specific cell markers, such as CD34 and keratin 15 (K15). Here, we describe a robust method for isolating bulge SCs and epidermal keratinocytes from mouse HFs utilizing fluorescence activated cell-sorting (FACS) technology. Isolated hair follicle SCs (HFSCs) can be utilized in various in vivo grafting models and are a valuable in vitro model for studying the mechanisms that govern multipotency, quiescence and activation.
Introduction
תאי גזע בוגרים (גיל) הם חיוניים לשמירה על הומאוסטזיס רקמות על ידי החלפת תאים מתים ותיקון רקמות שנפגעו על פציעה. גיל אלה מוגדרים על ידי היכולת שלהם לעבור התחדשות עצמית מתמדת להתמיין שושלות תאים שונות 1-3. המערכות למדו הטוב ביותר, אשר תלוי גיל מבוגר עבור החידוש שלהם, כוללות את מערכת hematopoietic, במעי 1,2,4 העור.
במהלך עובר, העור מתחיל כמו שכבה אחת של תאי אפידרמיס. המורפוגנזה של זקיק השיער (HF) מתחילה כאשר תאי mesenchymal לאכלס את העור ומהווה הדרמיס collagenous בסיסי 5. מתמחה תאים mesenchymal, כי מאוחר יותר מהווים את עורי פטמית (העקורים), לארגן ישירות מתחת לשכבת האפידרמיס וממריץ האפיתל כדי ליצור placodes השיער מתחיל לצמוח כלפי מטה 6. מאוד מתרבים תאי מטריקס, ממוקם בחלק התחתון של HF,מעטפת תאי mesenchymal אלה ויוצרים את השיער הנורה, בעוד השכבה הפנימית מתחילה להתמיין גלילים קונצנטריים לגבש השערה (HS) ואת נדן השורש הפנימי שמסביב (IRS) 2,3.
לאחר הינקות האפידרמיס בעור מורכב משלושה תאים: האפידרמיס interfollicular (IFE), בלוטת החלב (SG) ואת HF. בניגוד IFE ו SG אשר נמצא במצב מתמיד של הומאוסטזיס, את HF הוא איבר מיני דינמי אשר עובר מחזורים רצופים של צמיחה (anagen), הרס (קטגן) ומנוחה (telogen) 4,7. תאי גזע זקיק שיער (HFSCs) דלק כי במחזוריות בלתי פוסקת זו, הנמצאים ליד גומחה בתוך HF המכונית הבליטה 4. במהלך Anagen HFSCs לצאת הבליטה, העוקבים אחר איתות הפעלה מן העקורים, להתחיל מתרבה ויורד כלפי מטה ובכך ליצור שובל ליניארי ארוך של תאים המכונים נדן השורש החיצוני (ORS) 8-10. תאי מטריקס, כימקיפים את העקורים בבסיס של HF, מחזור במהירות ולהעביר שעברו התמיינות מסוף כלפי מעלה ובכך יצירת HS ואת 10 IRS (איור 1). משך anagen קובע את אורך השיער תלויה יכולת שגשוג והתמיינות של תאי מטריקס 6. כאשר HF נכנס קטגן, התאים מטריקס הגברה במעבר בהפסקת הנורה להתרבות, עוברים אפופטוזיס ו לסגת לחלוטין תוך משיכת העקורים כלפי מעלה עד שהוא מגיע אל החלק הלא-אופניים של 8,11 HF. במהלך הכחשה זו HF יוצרת מבנה זמני הידוע כאפיק אפיתל, אופייני קטגן, ומכילה הרבה תאים אפופטוטיים. בעכברים, קטגן נמשך בין 3-4 ימים, והוא מסונכרן מאוד במחזור השיער הראשון. כאשר HF מגיע telogen כל HFSCs להיות שקט. השלבים ברורים של מחזור HF גם מאופיינים שינויים בצבע העור העכבר של בשל מייצור elanin. השינויים העור משחור במהלך anagen כדי אפור כהה במהלך קטגן לוורוד במהלך telogen 6,7,12,13.
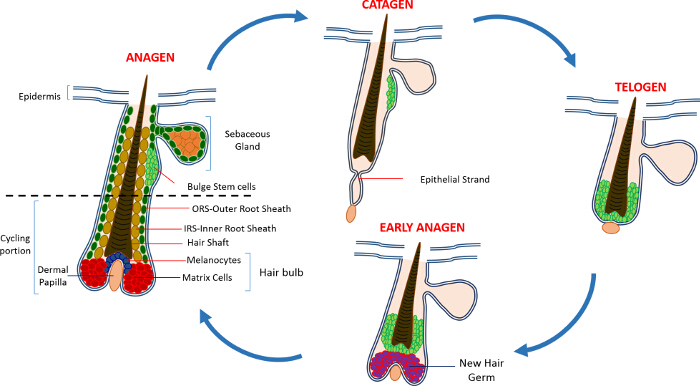
איור 1: מחזור זקיק השיער. HF מורכב בחלקו העליון קבע וחלק שיפוץ נמוך כל הזמן, רכיבה על אופניים, אשר עוברת מחזורים רצוף של צמיחה מהירה (anagen), הרס (קטגן) ושלב קפאון קרוב משפחה או שאר (telogen). אנא לחץ כאן כדי להציג גדול גרסה של נתון זה.
ה- SCS שמירה על HF זוהה בתחילה באמצעות ניסויי מרדף, עם thymidine tritiated, שחשפו אוכלוסייה של תאי שומרי תווית רכיבה איטית (LRC) ששכנו באזור הקבע של HF ממש מתחת SG 14. התקדמות HFSCאפיון חשף מספר קטן של סמנים כי ניתן להשתמש כדי לזהות ולבודד גיל ספציפי מן הנישה HF 15. אולי הסמן הטוב ביותר להעשרת HFSCs הוא CD34, סמן פני התא מזוהה גם כסמן SC hematopoietic בבני אדם 16. בתוך CD34 זה + אוכלוסיות שתי אוכלוסיות נפרדות גם בודדו מבוסס על integrin α6 ביטוי 2. סמן נוסף הוא קרטין 15 (K15) אשר מבוטא בכמות גבוהה באזור הבליטה, שיתוף לוקליזציה עם ביטוי CD34 ו אמרגן K15 משמש למיקוד ולבודד HFSCs בחיות מהונדסות 15,17-19. בעשור האחרון מספר אוכלוסיות נפרדות אחרות של HFSCs ו ובתאים גם דווחו להתגורר בתוך HF 17,20-27.
תכונה מרגשת נוספת של HFSCs תרומתם תיקון עור. בתנאים רגילים HFSCs לחדש את HF ואינו לוקח חלק הומאוסטזיס IFE. HoweVer, בתגובה פציעה, תאים אלה לצאת נישה SC שלהם וסיוע repopulating IFE 9. אנחנו הוכחנו לאחרונה כי עכברים שנמחקו עבור תצוגת הגן הפר-אפופטוטיים Sept4 / ARTS למספר גדל והולך של CD34, K15 ו Sox9 + HFSCs, מה שמראה על התנגדות אפופטוזיס. HFSCs בודד Sept4 / ARTS – / – עורות מגבים ניצול התא מופעל קרינת מיון (FACS) והיה יותר שני גידול של פי מספר CD34 + ו- K15 + HFSCs. ARTS Sept4 / אלה – / – HFSCs הורחב במבחנה ולא הוליד רק מושב יותר אבל היו גם מסוגל לעמוד בתנאים קשים בהשוואה לקבוצת ביקורת 28.
כתוצאה מכך שיש מספר גדל של HFSCs, Sept4 / ARTS – / – עכברים נרפאו מהר יותר באופן משמעותי בתגובת פציעות כריתת עור. באופן מפתיע, Sept4 / ARTS – / – עכברים displayeדה מספר רב של HFS מחדש ממיטת הפצע, וצלקות קטנות באופן משמעותי. יתר על כן, העכברים שנמחקו עבור XIAP (X-linked מעכב אפופטוזיס), ליעד ביוכימיים של ARTS, הפגינו ריפוי לקוי 28.
תוצאות העבודה שלנו בצעה במעבדות אחרות הראו כי HFSCs לשמש מודל אידיאלי עבור מחקר על הביולוגיה והתפקוד של גיל מבוגר. כאן אנו מתארים את המתודולוגיה של העשרה ובידוד של HFSCs ו קרטינוציטים אפידרמיס מבוסס על הביטוי של ארבעה סמנים: α6 integrin; β1 integrin; SCA-1 (סמן קרטינוציטים אפידרמיס) ו CD34. בידוד דומה K15 + HFSCs יכול גם להתבצע באמצעות עכבר כתב K15-GFP 19.
Protocol
Representative Results
Discussion
הפרוטוקול המתואר כאן הוא מבוסס היטב לבידוד HFSCs מהעור הגבי של עכברים בוגרים אבל יכול להיות מיושם באופן שווה לבידוד של אוכלוסיות אחרות בתוך מבנה HF, בהתבסס על הבחירה של סמנים 2,16,23,28,29. שיטה זו היא יתרון במיוחד על פני שיטות אחרות של בידוד תא, כגון דיסוציאציה רקמות, בכ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported in part by NIH grant RO1GM60124 (to H.S.). H.S. is an Investigator with the Howard Hughes Medical Institute. Y.F. is supported by the Deloro Career Advancement Chair and The German Israeli Foundation (I-2381-412.13/2015). D.S. is supported by the Coleman-Cohen post-doctoral fellowship.
Materials
| Isoflurane | Primal Critical Care | 66794-017-10 | |
| Carbon dioxide | – | – | |
| Electro Shaver | Oster | Golden A5 | Shaver from any other company could be used |
| 70% ethanol | Gadot Lab | 830000051 | 96% ehtanol diluted with distilled water |
| Dissection mat | Dissection tools from any provider can be used | ||
| Forceps | Dumont | 11251-10 | Foreceps from any other company could be used |
| Scissors | Dumont | 14094-11 | Scissors from any other company could be used |
| Needles/Pins | – | – | |
| Scalpel | Albion | 10 | Ensure that the scalpel has a blunt end |
| Tissue culture dish 60mm x 15mm | Sigma-Aldrich | CLS430166 | |
| PBS | – | In-house PBS without Calcium and Magnesium | |
| 0.25% Trypsin/EDTA | Biological Industries | 03-050-1A | Trypsin obtained from a different company might have a different activity and duration of the trypsin digest has to be adjusted accordingly |
| Pipettes 10ml | Sigma-Aldrich | Corning, 4488 | |
| Ice | – | – | |
| 50 ml sterie centrifuge tubes | Minplast Ein-shemer | 35050-43 | |
| 70µM Cell strainer | Fisher | 22362548 | |
| 40µM Cell strainer | Fisher | 22362549 | |
| Staining buffer | – | ||
| Centrifuge | Eppendorf 5804 R | 5805 000.017 | |
| FACS tubes with Cell strainer caps | Falcon | 352235 | |
| FACS tubes | Falcon | 352063 | |
| Integrin β1 | eBioscience | 25-0291 | 1:400 |
| Integrin α6 | eBioscience | 15-0495 | 1:600 |
| Sca I | eBioscience | 11-5981 | 1:200 |
| CD34 | eBioscience | 9011-0349 | 1:300 |
| DAPI | Sigma-Aldrich | D9542 | 50ng/ml |
| Dry Chelex | BioRad | 142-2842 | |
| Beaker | Pyrex | – | |
| Distilled H2O | – | – | |
| Stir bar | – | – | |
| NHCl | BioLab | 1903059 | |
| Fetal bovine serum (FBS) | Beit Haemek Biological Industries | 400718 | FBS obtained from a different company can be used |
| 1L glass bottle | Ilmabor | Boro 3.3 | |
| Bottle top filter | Autofil | 1102-RLS |
References
- Wagers, A. J., Weissman, I. L. Plasticity of adult stem cells. Cell. 116, 639-648 (2004).
- Blanpain, C., Lowry, W. E., Geoghegan, A., Polak, L., Fuchs, E. Self-renewal, multipotency, and the existence of two cell populations within an epithelial stem cell niche. Cell. 118, 635-648 (2004).
- Fuchs, E. Scratching the surface of skin development. Nature. 445, 834-842 (2007).
- Hsu, Y. C., Fuchs, E. A family business: stem cell progeny join the niche to regulate homeostasis. Nat Rev Mol Cell Biol. 13, 103-114 (2012).
- Blanpain, C., Fuchs, E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol. 10, 207-217 (2009).
- Alonso, L., Fuchs, E. The hair cycle. J Cell Sci. 119, 391-393 (2006).
- Muller-Rover, S., et al. A comprehensive guide for the accurate classification of murine hair follicles in distinct hair cycle stages. J Invest Dermatol. 117, 3-15 (2001).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5, 267-278 (2009).
- Ito, M., et al. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-1354 (2005).
- Hsu, Y. C., Pasolli, H. A., Fuchs, E. Dynamics between stem cells, niche, and progeny in the hair follicle. Cell. 144, 92-105 (2011).
- Fuchs, E. The tortoise and the hair: slow-cycling cells in the stem cell race. Cell. 137, 811-819 (2009).
- Plikus, M. V., Chuong, C. M. Complex hair cycle domain patterns and regenerative hair waves in living rodents. J Invest Dermatol. 128, 1071-1080 (2008).
- Ito, M., Kizawa, K., Hamada, K., Cotsarelis, G. Hair follicle stem cells in the lower bulge form the secondary germ, a biochemically distinct but functionally equivalent progenitor cell population, at the termination of catagen. Differentiation. 72, 548-557 (2004).
- Cotsarelis, G., Sun, T. T., Lavker, R. M. Label-retaining cells reside in the bulge area of pilosebaceous unit: implications for follicular stem cells, hair cycle, and skin carcinogenesis. Cell. 61, 1329-1337 (1990).
- Cotsarelis, G. Epithelial stem cells: a folliculocentric view. J Invest Dermatol. 126, 1459-1468 (2006).
- Trempus, C. S., et al. Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34. J Invest Dermatol. 120, 501-511 (2003).
- Morris, R. J., et al. Capturing and profiling adult hair follicle stem cells. Nat Biotechnol. 22, 411-417 (2004).
- Lyle, S., et al. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J Cell Sci. 111 (Pt 21), 3179-3188 (1998).
- Liu, Y., Lyle, S., Yang, Z., Cotsarelis, G. Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge. J Invest Dermatol. 121, 963-968 (2003).
- Vidal, V. P., et al. Sox9 is essential for outer root sheath differentiation and the formation of the hair stem cell compartment. Curr Biol. 15, 1340-1351 (2005).
- Snippert, H. J., et al. Lgr6 marks stem cells in the hair follicle that generate all cell lineages of the skin. Science. 327, 1385-1389 (2010).
- Nijhof, J. G., et al. The cell-surface marker MTS24 identifies a novel population of follicular keratinocytes with characteristics of progenitor cells. Development. 133, 3027-3037 (2006).
- Jensen, U. B., et al. A distinct population of clonogenic and multipotent murine follicular keratinocytes residing in the upper isthmus. J Cell Sci. 121, 609-617 (2008).
- Jensen, K. B., et al. Lrig1 expression defines a distinct multipotent stem cell population in mammalian epidermis. Cell Stem Cell. 4, 427-439 (2009).
- Jaks, V., et al. Lgr5 marks cycling, yet long-lived, hair follicle stem cells. Nat Genet. 40, 1291-1299 (2008).
- Horsley, V., et al. Blimp1 defines a progenitor population that governs cellular input to the sebaceous gland. Cell. 126, 597-609 (2006).
- Goldstein, J., Horsley, V. Home sweet home: skin stem cell niches. Cell Mol Life Sci. 69, 2573-2582 (2012).
- Fuchs, Y., et al. Sept4/ARTS regulates stem cell apoptosis and skin regeneration. Science. 341, 286-289 (2013).
- Nowak, J. A., Fuchs, E. Isolation and culture of epithelial stem cells. Methods Mol Biol. 482, 215-232 (2009).

