Confronto di tabacco metodi Host cellulare della proteina di rimozione da Blanching Piante intatte o mediante trattamento termico di estratti
Summary
Tre calore metodi di precipitazione sono presentati che rimuove efficacemente oltre il 90% delle proteine della cellula ospite (HCP) da tabacco estrae prima di qualsiasi altra fase di purificazione. L'impianto di operatori sanitari in modo irreversibile aggregare a temperature superiori a 60 ° C.
Abstract
Le piante non solo forniscono alimenti, mangimi e materie prime per l'uomo, ma sono stati sviluppati come un sistema di produzione economica per le proteine biofarmaceutiche, come gli anticorpi, vaccini candidati ed enzimi. Questi devono essere purificati dalla biomassa vegetale, ma passaggi di cromatografia sono ostacolati dalle alte concentrazioni di proteine della cellula ospite (operatori sanitari) in estratti di piante. Tuttavia, la maggior parte HCPs irreversibilmente aggregano a temperature superiori a 60 ° C agevolare successiva purificazione della proteina bersaglio. Qui, tre metodi vengono presentati per ottenere la precipitazione di calore degli operatori sanitari del tabacco in foglie sia intatte o estratti. Il pallore di foglie intatte può essere facilmente incorporato in processi esistenti, ma può avere un impatto negativo sulle successive fasi di filtrazione. L'opposto è vero per la precipitazione di calore di estratti di foglie in un recipiente agitato, che può migliorare le prestazioni delle operazioni a valle anche se con grandi cambiamenti nella progettazione apparecchiature di processo, qualiGeometria omogeneizzatore. Infine, una configurazione scambiatore di calore è ben caratterizzato in termini di condizioni di trasferimento di calore e facile in scala, ma pulizia può essere difficile e potrebbe esserci un impatto negativo sulla capacità del filtro. L'approccio progettuale-di-esperimenti può essere utilizzato per identificare i parametri di processo più importanti che influenzano la rimozione HCP e recupero del prodotto. Questo facilita l'applicazione di ciascun metodo in altre piattaforme di espressione e l'identificazione del metodo più adatto per una data strategia di purificazione.
Introduction
I moderni sistemi di assistenza sanitaria dipendono sempre più sulle proteine biofarmaceutiche 1. Produrre queste proteine nelle piante è vantaggioso a causa del basso carico patogeno e maggiore scalabilità rispetto ai sistemi di espressione convenzionali 2-4. Tuttavia, la lavorazione a valle (DSP) di farmaci di origine vegetale può essere difficile perché le procedure di estrazione dirompenti si traducono in un onere elevato di particelle, con torbidità superiore a 5.000 unità nefelometrica torbidità (NTU), e di proteine della cellula ospite (HCP) concentrazioni spesso superiore a 95 % [m / m] 5,6.
Procedure di chiarificazione elaborati sono tenuti a rimuovere particelle disperse 7-9, ma l'apparecchiatura cromatografia è meno costoso per operare in modalità bind-and-eluire durante il recupero iniziale del prodotto se c'è un passaggio precedente per la rimozione efficiente degli operatori sanitari 10,11. Ciò può essere ottenuto sia da precipitare la proteina bersaglio utilizzando flocculformiche 12 o basso pH 13,14, così come provocando la operatori sanitari di aggregare. L'aggregazione selettiva di ribulosio-1,5-bisfosfato carbossilasi / ossigenasi (Rubisco), l'operatore sanitario più abbondante nelle piante verdi come il tabacco (Nicotiana tabacum), può essere promossa aggiungendo polietilene glicole 15, ma questo è costoso e incompatibile con grande la produzione -scale. Il trattamento termico è stato dimostrato per denaturare e precipitare più del 95% degli operatori sanitari tabacco, mentre vaccini candidati proteina malaria come Vax8 rimangono stabili in soluzione 16-18.
Tre diversi approcci sono stati usati per ottenere la precipitazione indotta dal calore degli operatori sanitari tabacco: (i) la scottatura, cioè, l'immersione delle foglie intatte in liquido caldo, (ii) una temperatura controllata agitata nave, e (iii) uno scambiatore di calore ( Figura 1) 16. Per foglie intatte, scottatura raggiunto la precipitazione rapida ed efficace degli operatori sanitari ed era anche facilea scalare e compatibile con i processi di produzione su larga scala esistenti che includono un primo passo per lavare la biomassa vegetale 19. Al contrario, navi temperatura controllata sono già disponibili in alcuni processi e possono essere utilizzati per il trattamento termico di estratti vegetali 20, ma la loro scalabilità e velocità di trasferimento di energia è limitato perché il rapporto superficie-volume dei serbatoi è progressivamente ridotta e diventa inadatto a scala processo. Uno scambiatore di calore è un'alternativa tecnicamente ben definito per riscaldata navi agitate ma richiede un abbondante approvvigionamento di riscaldamento e mezzi di raffreddamento, ad esempio, vapore e acqua fredda, nonché una portata volumetrica strettamente controllato atto a geometria scambiatore di calore e proprietà dei media, ad esempio., la capacità termica specifica. Questo articolo mostra come tutti i tre metodi possono essere usati per la precipitazione indotta dal calore degli operatori sanitari tabacco e HCPs vegetali in genere. L'istituzione e il funzionamento di EACMetodo h in un ambiente di laboratorio può essere utilizzato per valutare la loro idoneità per processi su larga scala. La sfida principale è quello di individuare modelli in scala-down adeguati e condizioni di funzionamento per ogni operazione che assomigliano i dispositivi e le condizioni utilizzate durante la produzione processo di scala. I dati qui presentati si riferiscono ad esperimenti condotti con piante di tabacco transgeniche che esprimono la malaria candidato vaccino Vax8 e proteina fluorescente DsRed 16, ma il metodo è stato applicato con successo anche a N. piante benthamiana esprimere transitoriamente altre proteine biofarmaceutiche 21.
Un design-di-esperimenti (DOE) si avvicinano 22 può facilitare lo sviluppo di processo, e flocculanti 23 può anche essere utile in questo contesto, come descritto in precedenza 8. La differenza principale tra la scottatura, serbatoi riscaldati e scambiatori di calore è che sbiancamento viene applicata alle foglie intatte nelle prime fasi del processo mentre l'otlei sono applicati a estratti vegetali (Figura 1).
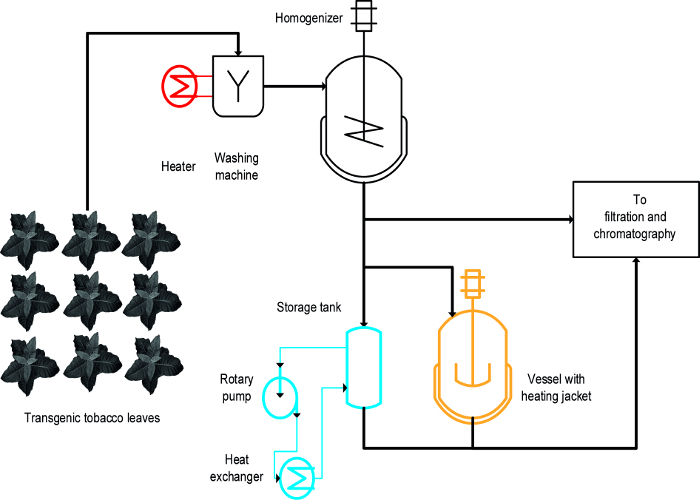
Figura 1:. Processo Schema di flusso che illustra la realizzazione di tre diversi metodi per il tabacco HCP calore Precipitazioni Il materiale vegetale è lavato ed omogeneizzato prima chiarificazione e purificazione. L'attrezzatura per il passo scottatura (rosso) può essere facilmente aggiunto al macchinario esistente. Al contrario, utilizzando un recipiente agitato (arancione) e, soprattutto, uno scambiatore di calore (blu) richiede uno o più dispositivi e tubi aggiuntivi. Clicca qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
I tre metodi per la precipitazione di calore sopra descritti possono rimuovere efficacemente operatori sanitari tabacco prima di ogni fase di purificazione cromatografica 16,17. Esse completano altre strategie che mirano ad aumentare la purezza iniziale del prodotto, ad esempio, guttazione 29, rhizosecretion 30 o centrifuga estrazione 31,32, che sono tutti limitati alle proteine secrete. Tuttavia, i metodi di calore a base possono essere usati solo in modo signi…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

