Bozulmamış Bitkiler Ağartma veya Ekstraktlarının Isıl İşlem tarafından Tütün Ana Hücre Proteini Temizleme Yöntemlerinin Karşılaştırılması
Summary
etkili bir tütün konakçı hücre proteinleri (HCp'ler) arasında% 90'dan daha fazla kaldırma çöktürme yöntemler sunulmuştur üç ısı başka saflaştırma aşamasından önce ayıklar. Bitki HCp'ler tersinmez 60 ° C'nin üzerindeki sıcaklıklarda bir araya getirir.
Abstract
Bitkiler insanlar için yiyecek, yem ve hammadde sağlamak değil, aynı zamanda bu antikorların, aşı adayları ve enzimler gibi biyofarmasötik proteinler, ekonomik bir üretim sistemi olarak geliştirilmiştir değil sadece. Bu bitki biyokütlesinin saflaştırılması gerekir, ancak kromatografi aşamaları, bitki ekstrelerinde konakçı hücre proteinleri (HCp'ler) yüksek konsantrasyonlarda girmesi engellenir. Bununla birlikte, çoğu HCp'ler geri dönüşü olmayan hedef proteinin daha sonraki saflaştırmayı kolaylaştıran 60 ° C'nin üzerindeki sıcaklıklarda bir araya getirir. Burada, üç yöntem sağlam yapraklar ya da özleri ya tütün CYp'lerine ısı yağış elde etmek için sunulmuştur. bozulmamış yaprakların blanching kolayca mevcut süreçlere dahil edilebilir ancak sonraki filtrasyon adımlar üzerinde olumsuz bir etkiye sahip olabilir. tersi gibi proses ekipman tasarımı büyük değişiklikler ile de olsa alt işlemleri performansını artırmak, karıştırılan kap içinde, yaprak ekstreleri ısı çökeltilmesi için de geçerlidirhomojenleştirici geometrisi. Son olarak, bir ısı değiştirici kurulumu iyi ısı transfer koşulları açısından karakterize ve ölçek kolay, ama temizlik zor olabilir ve filtre kapasitesi üzerinde olumsuz bir etki olabilir edilir. Tasarım-of-deneyler yaklaşımı HCP kaldırma ve ürün kurtarma etkileyen en uygun proses parametrelerini belirlemek için kullanılabilir. Bu, diğer sentezleme platformlarda her yöntemi ve belirli bir saflaştırma stratejisi için en uygun yöntem tanımlanması uygulamayı kolaylaştırır.
Introduction
Modern sağlık sistemleri giderek biofarmasötik proteinler 1 bağlıdır. Bitkilerde bu proteinlerin üretilmesi bilinen ekspresyon sistemleri 2-4 ile karşılaştırıldığında, düşük patojen yükü ve ölçeklenebilirlik avantajlıdır. yıkıcı çıkarma prosedürleri bulanıklıkları 5000 nefelometrik bulanıklık üniteleri (NTU) aşan ve konak hücre proteini (HCP) konsantrasyonları genellikle 95 aşan, yüksek parçacık yükü neden Ancak, bitkisel kökenli ilaçların aşağı işleme (DSP) zor olabilir % [m / m] 5,6.
Ayrıntılı açıklama prosedürleri dağınık parçacıklar 7-9 kaldırmak için gerekli, ancak kromatografi cihazı CYp'lerine 10,11 verimli çıkarılması için önceki bir adım varsa, ilk ürün kurtarma sırasında bağlama-ve-uzaklaştırma modunda çalışmaya daha pahalıdır vardır. Bu floccul kullanılarak hedef protein çökeltme yoluyla elde edilebilirkarıncalar 12 ya da düşük pH 13,14 yanı sıra HCp'ler araya neden olarak. Ribuloz-1,5-bisfosfat karboksilaz / oksijenaz (RUBISCO), tütün (Nicotiana tabacum), yeşil bitkilerde en bol HCP, seçici çekiş polietilen glikol 15 eklenmesi ile geliştirilebilir, ancak bu, pahalı ve geniş ile uyumsuz olabilir ölçeğindeki üretim. Isıl işlem örneğin Vax8 protein sıtma aşısı adayları çözelti 16-18 kararlı kalırken, denatüre ve tütün CYp'lerine fazla% 95 çökeltilmesi için gösterilmiştir.
Sıcaklık kontrollü bir kap karıştırılır (ii) (i) beyazlatma, örneğin, sıcak sıvı içinde sağlam yaprak daldırma, ve (iii) bir ısı eşanjörü (: Üç farklı yaklaşımlar, tütün CYp'lerine ısı kaynaklı çökelmesini elde etmek için kullanıldı Şekil 1) 16. sağlam yaprakları, CYp'lerine hızlı ve verimli yağış elde etti ve aynı zamanda kolay gerçekleştirilen ağartmabüyütmek ve bitki biyokütlesi 19 yıkamak için bir başlangıç aşamasını içerir mevcut büyük ölçekli üretim süreçleri ile uyumlu için. Bunun aksine, sıcaklık kontrollü DAMARLARIN bazı proseslerde kullanılabilir ve tank yüzey-hacim oranı, giderek azalır, çünkü bitkinin ısıl işlem 20 özler, ancak ölçeklenebilirlik ve enerji transferi hızı sınırlıdır için kullanılabilir ve süreç ölçeğinde uygun hale gelir. Bir ısı değiştirici de karıştırma kazanları ısıtıldı için teknik olarak iyi tanımlanmış bir alternatiftir ancak ısıtma ve soğutma ortamı, örn, buhar ve soğuk su bol miktarda bir kaynağı gibi ısı değiştirici geometrisine adapte edilmiş bir sıkı bir şekilde kontrol hacimsel akış hızı gerektirir medya özellikleri, örneğin., özgül ısı kapasitesi. Bu makalede, tüm üç yöntem, genel olarak, tütün CYp'lerine ve bitki CYp'lerine ısı kaynaklı çökeltme için nasıl kullanılabileceğini göstermektedir. kurulması ve EAC operasyonbir laboratuvar ortamında H yöntemi büyük ölçekli işlemler için uygunluklarını değerlendirmek için de kullanılabilir. büyük bir sorun süreci ölçekli üretim sırasında kullanılan cihazlar ve şartları andırır her işlem için yeterli ölçek aşağı modelleri ve çalışan koşullarını tespit etmektir. Burada sunulan veriler DsRed 16 sıtma aşısı adayı Vax8 floresan proteini ifade eden transgenik tütün bitkileri ile yapılan deneyler bakınız, ancak yöntem de başarılı N'ye uygulanmış benthamiana bitkiler geçici diğer biofarmasötik proteinleri 21 dile getirdi.
Bir tasarım-of-deneyler (DoE) işlem gelişimini kolaylaştırabilir 22 yaklaşım ve daha önce 8 açıklandığı gibi 23 de bu bağlamda yararlı olabilir flokülantlar. , Haşlama ısıtmalı kap ve eşanjör arasındaki temel fark bu beyazlaşma ot ise sürecin başlarında sağlam yapraklara uygulanan bironun bitki ekstreleri (Şekil 1) uygulanır.
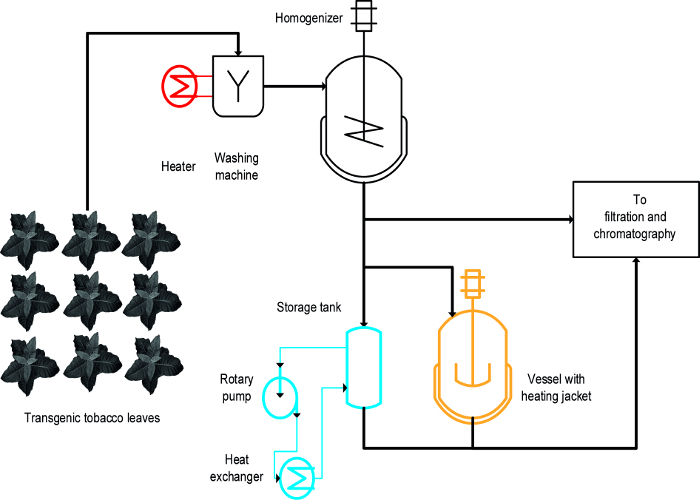
Şekil 1:. Tütün HCP Isı Yağış Üç Farklı Yöntemlerle uygulanmasını gösteren Süreç Akış Şeması bitki materyali yıkanmış ve açıklama ve arıtma önce homojenize edilir. ağartma adımı (kırmızı) için donatım kolayca mevcut makinelerin eklenebilir. Buna karşılık, bir karıştırılan gemi (turuncu) ve özellikle eşanjör (mavi) kullanarak bir veya birden fazla ek aygıtlar ve boru gerektirir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protocol
Representative Results
Discussion
Yukarıda açıklanan ısı yağış için üç yöntem etkili bir şekilde kromatografik saflaştırma adımı 16,17 önce tütün Onör puanı kaldırabilirsiniz. Bunlar, örneğin, ilk ürün saflığı, damlama 29 salgılanmış proteinler ile sınırlıdır hepsi rhizosecretion 30 ya da santrifüjlü ekstraksiyon 31,32 artırılmasını amaçlayan diğer metodlar tamamlar. hedef protein fazla 1 dakika boyunca ~ 60 ° C'de en az çökelme sıcaklığ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
References
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

