Utveckling och underhåll av en preklinisk patient Derived Tumör xenograft modell för undersökning av nya anti-cancerterapier
Summary
Med hjälp av patientgenererade tumörer i en subkutan preklinisk modell är ett utmärkt sätt att studera effekten av nya terapier, prediktiva biomarkörer upptäckt och läkemedelsresistenta vägar. Denna modell, i utvecklingsprocessen läkemedel är viktigt för att avgöra ödet för många nya cancerbehandlingar innan klinisk undersökning.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Kolorektal cancer (CRC) är en viktig bidragsgivare till dödsfall i cancer i USA. År 2015 fanns det uppskattningsvis 132,700 nya fall av CRC med 49.700 dödsfall 1. Även prognosen för patienter med lokaliserad sjukdom är utmärkt, patienter med avancerad sjukdom har dåliga resultat, vilket gör detta till en viktig prioritering i utvecklingen av nya terapier. Trots standardbehandling kemoterapeutiska regimer och nyare biologiska som distribueras mot denna sjukdom, har det bara varit en stegvis ökning i total överlevnad. Följaktligen finns det en betydande ansträngning för att förstå drivrutinsvägar involverade i att underlätta tumörtillväxt i denna sjukdom. Cancer Genome Atlas Network har nyligen identifierat ett antal huvudvägar som är inblandade i CRC dysreglering och inkluderar: WNT, fosfoinositid 3-kinas (PI3K), RAS, transformerande tillväxtfaktor-β (TGF β) och TP53 2. Tillsammans med undersökningar som beskriver othennes vägar som förstärker tillväxten i CRC har antänts utvecklingen av nyare behandlingar som syftar till att avsevärt förbättra överlevnaden i denna patientgrupp 3-5. Utnyttjar prekliniska modeller inom onkologi läkemedelsutveckling har varit avgörande i denna process för att förutsäga den kliniska aktiviteten av dessa nya föreningar.
Olika prekliniska modeller har använts i läkemedelsutvecklingen. Med tanke på att prekliniska transgena djurmodeller och odödliggjorda cellinjer har tappat målet att bestämma den kliniska aktiviteten av nya cancermedel, till stor del på grund av deras oförmåga att återspegla komplexiteten i mänskliga tumörer, har patient härlett tumör xenograft (PDTX) modeller fastställts. Den största fördelen med denna modell är att tumör heterogenitet förblir intakt och nära återspeglar de molekylära egenskaper och clonality av ursprungs patientens tumör 6-9. PDTX modeller ger ett utmärkt in vivopreklinisk plattform för att studera nya medel, läkemedelsresistens vägar, kombinatoriska strategier och cancer stamcellsbiologi 10.
En allmän översikt över PDTX process illustreras i figur 1. Den börjar i kliniken, samtyckande patienter för att tillåta en del av deras överskjutande tumörvävnaden som skall användas för denna forskning. Därefter, vid kirurgi, är en bit av tumören räknats av en patolog och tas i medier som skall transporteras till forskningspersonal. Omedelbart efter detta, är en sektion av tumören skärs i små bitar och transplanterades in i möss med immunbrist subkutant. När tumören växer, är det passe i olika generationer av möss för att bibehålla tumören 10. Typiskt, efter F3 generationen tumören kan utökas till en behandlingsstudie där nya föreningar och / eller kombinationsterapi utvärderas. Utnyttjar Next Gen Seq (exome Seq, RNA Seq och SNP array) potentiella prediktiva biomarkörer är upptäckaed att underlätta valet av patienter som kan drar nytta av en viss behandling.
De övergripande målen med att använda PDTX modeller är att: 1) utvärdera effekten av nya terapier som monoterapi eller i kombination och 2) identifiera prediktiva biomarkörer för känslighet eller motstånd före klinisk undersökning. I detta manuskript ger vi metodiken i initieringen och upprätthållandet av en CRC PDTX bank och ge fördelar och begränsningar av denna modell inom läkemedelsutveckling upptäckt.
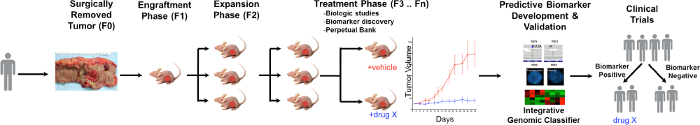
Figur 1. Översikt över CRC PDTX Model protokoll. En patient härlett tumör tas emot från kirurgi och injicerades omedelbart i atymiska nakna möss subkutant. När tumören växer expanderas i kommande generationer och så småningom utvidgas för behandlingsstudier. behandling Responses bedöms och prediktiva biomarkörer identifieras som kan underlätta patientens val. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Den PDTX läkemedelsutveckling plattform erbjuder en förbättrad modell för bristerna i andra prekliniska modeller som är opålitliga i att förutsäga kliniska aktiviteten av nya föreningar. Viktigt, tumörer i denna modell är biologiskt stabil, behålla metastatisk potential, och uppvisar liknande läkemedel lyhördhet från generation till generation. I denna modell, är patienten härledda tumörer injiceras i atymiska nakna möss, passe, och därefter används vid terapeutisk utvärdering. Det finns flera vikt…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

