전임상 환자 유래 종양 소설 안티 - 암 치료의 조사를위한 이종 이식 모델의 개발 및 유지 보수
Summary
피하 전임상 모델에서 환자 유래 종양을 활용하여 새로운 치료법, 예측 바이오 마커의 발견 및 약제 내성 경로의 효능을 연구 할 수있는 좋은 방법입니다. 이 모델은 신약 개발 과정에서 임상 시험에 앞서 많은 신규 항암 요법의 운명을 결정하는데 중요하다.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
대장 암 (CRC)는 미국에서 암 사망에 크게 기여. 2015 년, 49,700 사망 1 CRC의 예상 132,700 새로운 사례가 있었다. 국소 질환 환자의 예후가 우수하지만, 고급 질환 환자는 신규 치료법의 개발이 중요한 우선 순위 결정, 불량한 결과를 갖는다. 치료 화학 요법이 질병에 배포 된 새로운 생물학적 제제의 기준에도 불구하고, 전체 생존 만 증분 증가하고있다. 따라서,이 질병에서 종양 성장을 촉진 관련된 드라이버 경로를 이해하는데 상당한 노력이 존재한다. 암 게놈 아틀라스 네트워크는 최근 다수의 주요 CRC의 이상 조절에 관여하고 포함하는 경로 확인했습니다 : WNT를, 포스 3- 키나제 (PI3K), RAS, 변형 성장 인자 β (TGF-β의)와 TP53 2. 함께 조사는 오티 설명과 함께CRC 성장을 강화할 그녀의 경로를 크게이 환자군 3-5 생존을 개선하기위한 새로운 치료법의 개발을 촉발 하였다. 종양 치료제 개발에 활용 전임상 모델은 이러한 신규 한 화합물의 임상 적 활성을 예측하는 과정이 필수적이었다.
다양한 전임상 모델은 신약 개발 과정에서 사용되어왔다. 전임상 트랜스 제닉 동물 모델 및 세포주 크게 때문에 인간 종양의 복잡도를 반영하기 위해 자신의 무능력을, 신규 종양 치료법의 임상 적 활성을 결정하는데 성공적이지 않은 불멸화 것을 고려하면, 환자 유래의 종양 이종 이식 (PDTX) 모델이 확립되었다. 이 모델의 가장 큰 장점은 종양 이질성은 그대로 유지하고 밀접하게 원래 환자 종양 6-9의 분자 특성과 clonality을 반영하는 것입니다. PDTX 모델은 생체 내에서 우수한을 제공전임상 플랫폼은 새로운 에이전트, 약물 내성 경로, 조합 전략, 암 줄기 세포 생물학 (10)을 공부한다.
PDTX 공정의 일반적인 개요는도 1에 도시되어있다. 또한, 병원에서 시작 그 초과 종양 조직이 일부 연구에 사용될 수 있도록 환자 동의. 다음으로, 수술로 종양의 조각은 병리학 자에 의해 싫어할하고 연구 인력으로 운반 할 미디어에 넣어. 바로 그 후, 종양의 단면은 작은 조각으로 절단하고, 면역 결핍 마우스의 피하에 이식. 종양 성장 후에는 종양 (10)을 유지하기 위해 다른 세대의 마우스로 계대된다. 전형적으로, F3 생성 후에 종양은 신규 화합물 및 / 또는 조합 치료를 평가 치료 연구로 확장 될 수있다. 활용하여 차세대 서열 (엑솜 서열, RNA 서열과 SNP 어레이) 가능성 예측 바이오 마커 발견하다특정 치료에서 효과를 유도 할 수있다 환자의 선택에 도움 에디션.
1) 단일 에이전트로 또는 조합하여 새로운 치료법의 효능을 평가하고 2) 이전에 임상 시험에 대한 민감도 또는 저항의 예측 바이오 마커를 식별 : PDTX 모델을 사용하는 무엇보다 중요한 목표로합니다. 이 논문에서, 우리는 CRC PDTX 은행의 개시 및 유지 보수 방법론을 제공하고 신약 개발의 발견이 모델의 장점과 한계를 제공합니다.
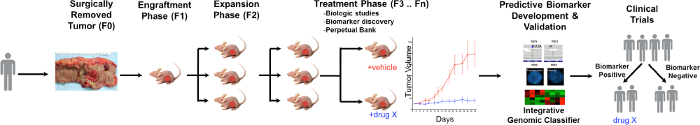
CRC를 PDTX 모델 프로토콜의 그림 1. 개요. 환자 유래의 종양은 수술받은 즉시 피하 무 흉선 누드 마우스에 주입된다. 종양이 성장하면 그것은 다음 세대로 확장하고 결국 치료 연구에 확장됩니다. 치료 RESPONSE를을 평가하고 예측 바이오 마커는. 환자 선택에 도움을 수 식별 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
PDTX 신약 개발 플랫폼은 신규 화합물의 임상 활동을 예측 신뢰할 수없는 다른 전임상 모델의 단점을 개선 모델을 제공합니다. 중요한 것은,이 모델에서 종양이 생물학적으로 안정, 전이성 잠재력을 보유하고 세대 유사한 약물 반응성을 나타낸다. 이 모델에서, 환자 유래의 종양은 무 흉선 누드 마우스에 주사 계대하고,이어서 치료의 평가에 사용된다. 등 성공적인 PDTX 은행에 대한 몇 가지 중요한 …
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

