Разработка и ведение доклинической пациента Derived Опухоль модели ксенотрансплантата для исследования принципиально новых видов лечения рака
Summary
Используя опухоли пациента, полученных в подкожный доклинической модели является отличным способом для изучения эффективности новых методов лечения, открытие предиктивного биомаркеров и путей лекарственной устойчивостью. Эта модель, в процессе разработки лекарственных средств, имеет важное значение в определении судьбы многих новых видов лечения противоопухолевыми до клинического исследования.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
Колоректальный рак (CRC) является существенным фактором смерти от рака в Соединенных Штатах. В 2015 году насчитывалось 132,700 новых случаев КПР с 49,700 смертей 1. Хотя прогноз у пациентов с локализованным заболеванием превосходна, у пациентов с прогрессирующим заболеванием имеют плохие результаты, делая это основным приоритетом в разработке новых видов лечения. Несмотря на стандарт медицинской помощи химиотерапевтических препаратов и новых биопрепаратов, которые развернуты против этого заболевания, наблюдается лишь постепенное увеличение общей выживаемости. Соответственно, существует значительное усилие в понимании путей водителей, участвующих в обеспечении роста опухоли при этом заболевании. Атлас генома рака Сеть недавно выявила многочисленные основные пути , которые вовлечены в CRC дерегуляции и включают: WNT, фосфоинозитидного 3-киназы (PI3K) РАН, трансформирующий фактор роста β (TGF – β) и TP53 2. Вместе с исследованиями с описанием OTее пути , которые потенцируют рост в КПР зажгли развитие новых методов лечения , направленных на существенное улучшение выживаемости в этой популяции пациентов 3-5. Использу доклинические модели развития онкологической наркотиков имели важнейшее значение в этом процессе в прогнозировании клинической активности этих новых соединений.
Различные доклинические модели были использованы в процессе разработки лекарственных средств. Учитывая, что доклинические трансгенные животные модели и увековечены клеточные линии были неудачны в определении клинической активности новых онкологических терапии, в основном из-за их неспособности отразить сложность человеческих опухолей, были созданы пациента происхождения опухоли ксенотрансплантата (PDTX) модели. Самым большим преимуществом этой модели является то , что опухоль гетерогенность остается неповрежденным и точно отражает молекулярные характеристики и клональности от инициирующего опухоли пациента 6-9. Модели PDTX обеспечивают превосходную в естественных условияхдоклинические платформа для изучения новых агентов, путей лекарственной устойчивости, комбинационные стратегии и биологии стволовых клеток рака 10.
Общий обзор процесса PDTX показан на рисунке 1. Она начинается в клинике, по обоюдному согласию пациентов , чтобы некоторые из их избыточной ткани опухоли , которые будут использоваться для этого исследования. Далее, во время операции, часть опухоли грязными патологоанатомом и положить в средствах массовой информации, которые будут перевезены в научных кадров. Сразу же после этого, участок опухоли нарезают на мелкие кусочки и трансплантировали в иммунодефицитных мышей подкожно. После того , как опухоль растет, она пассируют в разных поколений мышей с целью поддержания опухоли 10. Как правило, после F3 поколения опухоль может быть расширена в исследовании лечения, где новые соединения и / или комбинационные терапии оцениваются. Использу Next Gen Seq (ExoME Seq, Секвенирование РНК и SNP массив) потенциальные прогностические биомаркеры обнаружитье изд, которые помогают в отборе пациентов, которые могут получить выгоду от конкретного лечения.
Общие цели использования моделей PDTX заключаются в следующем: 1) оценить эффективность новых методов лечения как монотерапии или в комбинации и 2) определить прогностические биомаркеры чувствительности или устойчивости до клинического исследования. В этой рукописи, мы предлагаем методологию в инициации и поддержании банка CRC PDTX и обеспечивают преимущества и недостатки этой модели в открытии разработки лекарственных средств.
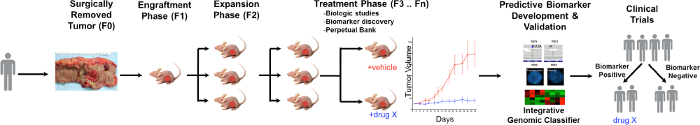
Рисунок 1. Обзор типового протокола CRC PDTX. Пациент получен опухоль , полученная от операции и сразу же вводили в бестимусных голых мышей подкожно. После того, как опухоль растет она раскрывается в последующих поколениях, и в конечном итоге расширить для исследований лечения. Лечение RespoNSES оцениваются и прогностические биомаркеры идентифицированы , которые могут помочь в отборе пациентов. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Платформа открытия препарата PDTX предлагает улучшенную модель к недостаткам других доклинических моделей, которые являются ненадежными при прогнозировании клинической активности новых соединений. Важно отметить, что опухоли в этой модели являются биологически стабильными, сохраняю…
Divulgations
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 minutes at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phospate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at room temperature |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | none | |
| Anesthesia box | Patterson Veterinary | none | |
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3′ UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts (“xenopatients”) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).

