Efterligning af funktion signalproteiner: Mod Artificial Signal transduktion Therapy
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
Signaltransduktionsveje spiller en væsentlig rolle i næsten alle cellulær proces og tillade cellen kan reagere hurtigt på miljømæssige signaler. 1 Disse veje er ofte udløses ved binding af et signalmolekyle til en ekstracellulær receptor, hvilket resulterer i aktivering af intracellulære enzymer. Amplifikation og formering af dette signal i cellen medieres af funktionen af signalering proteiner, der danner et netværk af protein-protein-interaktioner, hvor enzymer er reversibelt aktiveres med høj specificitet. Fordi dysregulering af disse netværk ofte fører til udvikling af cancer, har der været megen interesse for at etablere 'signaltransduktion terapi af cancer', 2, hvorved lægemidler er designet til at forstyrre maligne signalveje. Vi har for nylig foreslået en alternativ tilgang til signaltransduktion terapi, der er afhængig af lægemidlers evne til at generere unaturlige signaltransduktionsveje. <sup> 3 Især mener vi, at ved at designe syntetiske midler, der efterligner funktionen af signalproteiner, ville det være muligt at modulere cellens funktion indirekte. For eksempel kan disse kunstige net aktivere protein biomarkører til at aktivere enzymer, der spalter prodrugs. Alternativt kan disse signaling protein mimetika kunne aktivere unaturlige celle signalveje, hvilket resulterer i terapeutiske virkninger.
For at demonstrere gennemførligheden af denne fremgangsmåde, har vi for nylig skabt et syntetisk "kemisk transducer» 4, der muliggør blodpladeafledt vækstfaktor (PDGF) at udløse spaltningen af et anticancer prodrug ved at aktivere glutathion-s-transferase (GST), som er ikke sin naturlige bindingspartner. Strukturen af denne "transducer" består af et anti-PDGF DNA aptamer, som er modificeret med en bivalent hæmmer til GST. Derfor har dette syntetiske middel tilhører en familie af molekyler med bindingssteder tilforskellige proteiner, 5-7 såsom kemiske inducere af dimerisering (kunde-id'er) 8-10 og også til gruppen af protein-bindere baseret på oligonucleotid-syntetisk molekylekonjugater. 11-21
De generelle principper ligger til grund for udformningen af sådanne systemer er beskrevet heri og detaljerede protokoller til syntese og teste funktionen af denne "transducer" med konventionelle enzymatiske assays leveres. Dette arbejde skal lette udvikle yderligere "transducere« i denne klasse, som kan anvendes til at mediere intracellulær protein-protein-kommunikation og dermed til at inducere kunstige celle signalveje.
Figur 1 beskriver skematisk funktionsprincipperne for syntetiske »kemiske transducere ', der kan mægle unaturlige protein-protein-kommunikation. I denne illustration, en 'kemisk transducer ", der integrerer syntetiske bindemidler til proteins I og II (bindemidler I og II), gør det muligt for protein II til at udløse den katalytiske aktivitet af protein I, som ikke er dets naturlige bindingspartner. I fravær af protein II, transduceren binder det katalytiske sted i enzymet (protein I) og inhiberer dets aktivitet (figur 1, stat ii). Bindingen af "transducer" til protein II imidlertid fremmer interaktioner mellem bindemiddel I og overfladen af protein II (Figur 1, state iii), hvilket reducerer dens affinitet mod protein I. Som følge heraf den effektive koncentration af " fri "transducer i opløsningen reduceres, hvilket fører til dissociation af transduceren-protein-i-kompleks og til reaktivering af protein i (figur 1, tilstand iv). Tilsammen disse trin fremhæve tre grundlæggende principper bag udformningen af effektive 'transducere «: (1) en" transducer "bør have en specifik bindemiddel for hver af de protein-targets, (2) samspillet betweOr bindemiddel II og protein II bør være stærkere end vekselvirkningen mellem bindemiddel I og protein I, og (3) bindemiddel jeg skal kunne interagere med overfladen af proteinet II. Denne sidste princip kræver ikke nødvendigvis, at bindemiddel jeg alene ville have en høj affinitet og selektivitet mod protein II. I stedet er den baseret på vores nylige undersøgelser, som viste, at vil kunne fremme interaktioner mellem dette molekyle og overfladen af proteinet bringe en syntetisk molekyle i nærhed til et protein. 19,22,23
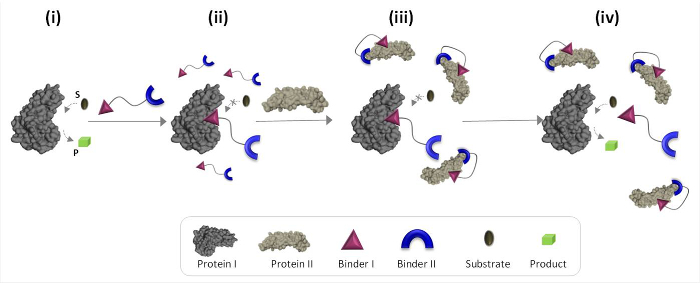
Figur 1:. Betjening principper for »kemiske transducere" Når "kemisk transducer« tilføjes til et aktivt protein I (tilstand i), det binder sig til sin aktive site gennem bindemiddel I og hæmmer dets aktivitet (state ii). I nærvær af protein II, men den ubundne "kemisk transducer 'interagerer med protein II gennem bindemiddel II, der fremmer interaktioner mellem bindemiddel I og overfladen af proteinet II. Denne inducerede binder I-protein II interaktion reducerer den effektive koncentration af bindemiddel I, som fører til dissociation af 'transducer'-protein I kompleks og til protein I reaktivering (state iv). Klik her for at se en større version af dette tal .
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev støttet af Minerva Foundation, HFSP Organization, og et europæisk forskningsråd Grant (Starting Grant 338.265).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
References
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochimie. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

