Een eenvoudige en efficiënte Protocol voor de katalytische Insertion polymerisatie van Functional norbornenen
Summary
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Abstract
Norborneen kunnen worden gepolymeriseerd door een verscheidenheid van mechanismen, waaronder insertie polymerisatie waarbij een dubbele binding is gepolymeriseerd en bicyclische aard van het monomeer behouden. Het verkregen polymeer, polynorborneen, een hoge glasovergangstemperatuur, Tg, en interessante optische en elektrische eigenschappen. Echter, de polymerisatie van functionele norbornenen door dit mechanisme gecompliceerd door het feit dat de endo gesubstitueerd norborneen monomeer in het algemeen een zeer lage reactiviteit. Bovendien is de scheiding van de endo gesubstitueerde monomeer uit de exo monomeer een vervelende taak. Hier presenteren we een eenvoudig protocol voor de polymerisatie van gesubstitueerde norbornenen (endo: exo ca. 80:20) waarop hetzij een carbonzuur of een aanhangende dubbele binding. De werkwijze vereist niet dat beide isomeren worden gescheiden, en gaat met lage katalysatorbeladingen (0,01-0,02 mol%). Het polymeer dragende Pendmier dubbele bindingen kan verder worden omgezet in een hoge opbrengst, een polymeer lager hanger epoxygroepen veroorloven. Deze eenvoudige procedures kunnen worden toegepast op polynorbornenen bereiden met verschillende functionele groepen, zoals esters, alcoholen, imiden, dubbele bindingen, carbonzuren, broom-alkylen, aldehyden en anhydriden.
Introduction
Norborneen, NBE, de Diels-Alder adduct van etheen en cyclopentadieen (verkregen door "kraken" van dicyclopentadieen (DCPD)), wordt gemakkelijk gepolymeriseerd met behulp van vrije-radicaalpolymerisatie, 1 kationische polymerisatie, 2 ringopening metathese polymerisatie 3 en katalytische insertie polymerisatie. 4, 5, 6, 7 In tegenstelling tot de andere mechanismen, de katalytische polymerisatie insertie leidt tot de vorming van een zeer hoge glasovergangstemperatuur (Tg) polymeer waarbij de bicyclische ruggengraat van NBE behouden. Verschillende katalysatoren zoals metalloceen katalysatoren en late overgangsmetaal katalysatoren kunnen worden gebruikt voor de polymerisatie van NBE bevorderen. 4, 5, 6, <sup class = "xref"> 7 Echter, vanwege de lage oplosbaarheid en door de problemen bij de verwerking van een zeer hoge Tg polymeer, de PNBE homopolymeer is, voor zover wij weten, nooit gevonden elk gebruik.
Functionele polynorbornenen (PNBEs) hebben het voorwerp van aanzienlijke onderzoek voor de laatste 20 jaar, omdat ze combineren de hoge Tg bijgebracht door de bicyclische rigide repeterende eenheid evenals wenselijke eigenschappen begiftigd door hun functionaliteiten. 8, 9, 10 NBE monomeren verkregen uit vrij eenvoudige en goedkope grondstoffen, onder toepassing van een één-stap Diels-Alder-reactie tussen cyclopentadieen en een gefunctionaliseerd dienofiel. De Diels-Alder-reactie leidt tot twee stereoisomeren, endo- en exo, die zeer verschillende reactiviteiten hebben. 11, 12 in feite de endo stereoisomeer is minder reactief dan exo vorm en deactiveert de katalysator. 11, 12 derhalve in het verleden, de bereiding van functionele polynorbornenen gewoonlijk vereist de scheiding van de endo- en exo stereoisomeren, en alleen de exo stereoisomeer gebruikt. Een dergelijke scheidingswerkwijze was tijdrovend, en leidde tot de accumulatie van ongereageerde endo stereoisomeren als ongewenst afval.
Onlangs hebben we aangetoond dat de polymerisatie van de gefunctionaliseerde NBEs die zowel stereoisomeren in feite haalbaar. 13 We hebben dus in staat om een verscheidenheid van gesubstitueerde PNBEs bereiden, die functionele groepen zoals esters, anhydriden, aldehyden, imiden en alkoholen dubbele bindingen zijn. Vanwege hun hoge Tg en functionaliteit kunnen deze polymeren vertonen wenselijke eigenschappen. We beschrijven hier twee methoden om functionele polymeren te bereiden. Het eerste leidt totde synthese van het in water oplosbare polymeer poly (5-norborneen-2-carbonzuur), PNBE (CO 2 H), onder toepassing van een kationische Pd-katalysator (figuur 1). 13, 14 Dezelfde polymerisatiewerkwijze kan worden gebruikt om functionele PNBEs diverse hanger functionaliteiten, zoals esters, alcoholen, imiden, broom-alkylen, aldehyden en anhydriden bereid. In onze handen, kan deze kationische Pd katalysator niet worden gebruikt NBEs dat aanhangende dubbele bindingen zoals 5-vinyl-2-norborneen. In dit geval, een gedeeltelijke insertie van de hanger dubbele binding tijdens de polymerisatie leidt tot de vorming van een verknoopt materiaal. Daarom presenteren we hier een tweede werkwijze gewijd aan de vorming van poly (5-vinyl-2-norborneen), PNBE (vinyl), middels Pd2 (dba) 3: AgSbF 6: PPh3 als katalysator in situ. 14 De vinylzijgroepen van het polymeer worden verder geëpoxideerde, leiden tot the vorming van PNBE (epoxy) (figuur 1). Zowel PNBE (CO 2 H) en PNBE (epoxy) gevonden te leiden tot de vorming van thermohardende harsen met een Tg zo hoog als 350 ° C. 14 Zo is de eenvoudige hier beschreven methode maakt het mogelijk om efficiënt polymeren te bereiden met een hoge Tg en een verscheidenheid aan functionele groepen, die kunnen worden gebruikt voor talrijke toepassingen.
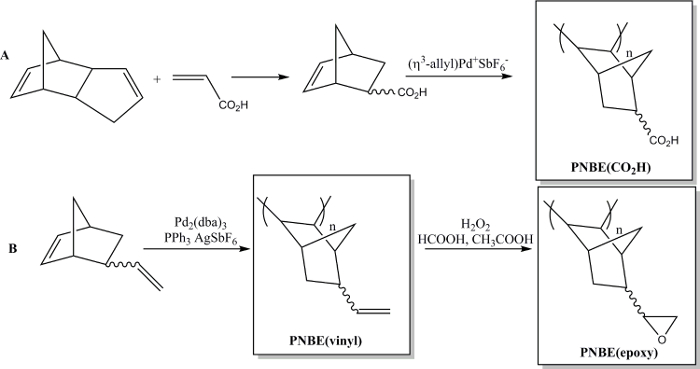
Figuur 1: Functionele PNBEs bereid door Pd gekatalyseerde polymerisatie. (A) de voorbereiding van PNBE (CO 2 H), (B) de voorbereiding van PNBE (vinyl) en PNBE (epoxy). De gestippelde band geeft een mengsel van endo en exo-isomeren. Klik hier om een grotere versie van deze fi bekijkenguur.
Protocol
Representative Results
Discussion
De hier voorgestelde methode is eenvoudig en gemakkelijk vatbaar voor opschaling. Alle chemicaliën kunnen worden gebruikt zoals ontvangen zonder zuivering. Merk op dat het uitvoeren van de reactie bij een lagere schaal (bijv schalen ≤1 g) meestal levert lagere opbrengsten als gevolg van een onvermijdelijke verlies van materiaal tijdens de behandeling en de collectie.
De katalysatoren worden in situ gevormd na de reactie van commerciële Pd verbindingen met kationisch mak…
Divulgations
The authors have nothing to disclose.
Acknowledgements
The authors acknowledge funding from Fonds de Recherche du Québec – Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Materials
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
References
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist’s Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).

